電解質
以離子鍵或極性共價鍵結合的物質
電解質是溶於水溶液中或在熔融狀態下就能夠導電的化合物。根據其水溶液或熔融狀態下導電性的強弱,可分為強電解質和弱電解質。
電解質都是以離子鍵或極性共價鍵結合的物質。化合物在溶解於水中或受熱狀態下能夠解離成自由移動的離子。離子化合物在水溶液中或熔化狀態下能導電;某些共價化合物也能在水溶液中導電,但也存在固體電解質,其導電性來源於晶格中離子的遷移。
強電解質(strong electrolyte)是在水溶液中或熔融狀態中幾乎完全發生電離的電解質,完全電離,不存在電離平衡。弱電解質(weak electrolyte)是在水溶液中或熔融狀態下不完全發生電離的電解質。強弱電解質導電的性質與物質的溶解度無關。
一般有:強酸、強鹼,活潑金屬氧化物和大多數鹽,如:硫酸、鹽酸、碳酸鈣、硫酸銅等。
一般有:弱酸、弱鹼,少部分鹽,如:醋酸、一水合氨()、醋酸鉛、氯化汞。另外,水是極弱電解質。
決定強、弱電解質的因素較多。下面從鍵型、鍵能、溶解度、濃度和溶劑等方面來討論這些因素對電解質電離的影響。
(1)鍵型
電解質的鍵型不同,電離程度就不同。已知典型的離子化合物,如強酸、強鹼和大部分鹽類,在極性水分子作用下能夠全部電離,導電性很強,我們稱這種在水溶液中能夠完全電離的物質為強電解質。而弱極性鍵的共價化合物,如弱酸、弱鹼和少數鹽類,在水中僅部分電離,導電性較弱,我們稱這種在水溶液中只能部分電離的物質為弱電解質。所以,從結構的觀點來看,強、弱電解質的區分是由於鍵型的不同所引起的。但是,僅從鍵型強弱來區分強、弱電解質是不全面的,強極性共價化合物也有屬於弱電解質的情況,HF就是一例。因此,物質在溶液中存在離子的多少,還與其他因素有關。
(2)鍵能
相同類型的共價化合物由於鍵能不同,電離程度也不同。例如,HF、HCl、HBr、HI就其鍵能來說是依次減小的,它們分子內核間距的依次增大。從分子的鍵能依次減小來看,HF的鍵能最大,分子結合得最牢固,在水溶液中電離最困難。再加上HF分子之間由於形成氫鍵的緣故而有締合作用,雖然在水分子的作用下一部分HF離子化,離解為和,但離解出來的很快地又和HF結合成為、、等離子。在1 mol/L HF溶液中,僅佔1%,佔10%,而大部分都是多分子聚合的離子:、、,這樣就使HF成為一種弱酸,而HCl、HBr、HI都是強酸。從HCl→HI,它們分子內的核間距依次增大,鍵能依次減小,所以它們的電離度逐漸略有所增大。但是,僅從鍵能大小來區分強、弱電解質也是片面的,有些鍵能較大的極性化合物也有屬於強電解質的情況。例如,H—Cl的鍵能(431.3 kJ/mol)比H—S的鍵能(365.8 kJ/mol)大,在水溶液中HCl卻比H2S容易電離。
(3)溶解度
電解質的溶解度也直接影響著電解質溶液的導電能力。有些離子化合物,如、等,儘管它們溶於水時全部電離,但它們的溶解度很小,使它們的水溶液的導電能力很弱,但它們在熔融狀態時導電能力很強,因此仍屬強電解質。
(4)濃度
電解質溶液的濃度不同,電離程度也不同。溶液越稀,電離程度越大。鹽酸和硫酸只有在稀溶液中才是強電解質,在濃溶液中,則是弱電解質。由蒸氣壓的測定知道10 mol/L的鹽酸中有0.3%是共價分子,通常當溶質中以分子狀態存在的部分少於千分之一時就可認為是強電解質,因此10 mol/L的鹽酸中HCl是弱電解質。
(5)溶劑
溶劑的性質也直接影響電解質的強弱。對於離子化合物來說,水和其他極性溶劑的作用主要是削弱晶體中離子間的引力,使之解離。根據庫侖定律,離子間的引力為:
式中k為靜電力常量,為離子的電量,r為離子間距離,ε為溶劑的介電常數。從上式可以看出,離子間引力與溶劑的介電常數成反比。水的介電常數ε=81,所以像LiCl、KCl這些離子化合物,在水裡易於電離,表現出強電解質的性質。而乙醇和苯等介電常數較小(乙醇ε=27,苯ε=2),離子化合物在其中難於電離,表現出弱電解質的性質。
因此弱電解質和強電解質,並不是物質在本質上的一種分類,而是由於電解質在溶劑等不同條件下所造成的區別,彼此之間沒有明顯的界限。
電解是使電流通過電解質溶液或熔融狀態的電解質,而在陰陽兩極引起氧化還原反應的過程。這一過程是將電能轉變為化學能的過程。電解的條件是外加電源、電解質溶液或熔融的電解質、閉合迴路。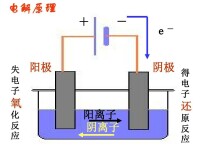

電解質
例如,水的電解,電解槽中陰極為鐵板,陽極為鎳板,電解液為氫氧化鈉溶液。通電時,在外電場的作用下,電解液中的正、負離子分別向陰、陽極遷移,離子在電極 - 溶液界面上進行電化學反應。在陽極上進行氧化反應,在陰極上進行還原反應。水的電解就是在外電場作用下將水分解為(g)和(g)。電解是一種非常強有力的促進氧化還原反應的手段,許多很難進行的氧化還原反應,都可以通過電解來實現。例如:可將熔融的氟化物在陽極上氧化成單質氟,熔融的鋰鹽在陰極上還原成金屬鋰。電解工業在國民經濟中具有重要作用,許多有色金屬和稀有金屬的冶鍊及金屬的精鍊,基本化工產品的製備,還有電鍍、電拋光、陽極氧化等,都是通過電解實現的。
電解質和非電解質的區別:
電解質是在水溶液或熔融狀態下可以導電的化合物;非電解質是在水溶液或熔融狀態下都不能導電的化合物。單質、混合物不管在水溶液中或熔融狀態下是否能夠導電,都不是電解質或非電解質。如所有的金屬既不是電解質,也不是非電解質。因它們並不是化合物,不符合電解質的定義。
1、是否能電離(本質區別):電解質是在一定條件下可以電離的化合物,而非電解質不能電離。
2、常見物質類別:電解質一般為酸、鹼、鹽、典型的金屬氧化物和某些非金屬氫化物。非電解質通常為非金屬氧化物、某些非金屬氫化物和絕大多數有機物。
3、化合物類別:電解質為離子化合物和部分共價化合物,非電解質全部為共價化合物。
電解質在人體中的作用及平衡調節
電解質在人體中具有重要作用。水和電解質廣泛分佈在細胞內外,參與體內許多重要的功能和代謝活動,並且電解質對正常生命活動的維持起著非常重要的作用。人體內電解質分佈情況是這樣的:在正常人體內,鈉離子占細胞外液陽離子總量的92%,鉀離子占細胞內液陽離子總量的98%左右。鈉、鉀離子的相對平衡,維持著整個細胞的功能和結構的完整。水、電解質代謝紊亂可使全身各器官系統,特別是心血管系統、神經系統的生理功能和機體的物質代謝發生相應的障礙,嚴重時常可導致死亡。
水、電解質的平衡,受神經系統和某些激素的調節,而這種調節又主要是通過神經特別是一些激素對腎處理水和電解質的影響而得以實現的。
1、維持體液滲透壓和水平衡
2、維持體液的酸鹼平衡
體液電解質組成緩衝對調節酸鹼平衡。
3、維持神經、肌肉的應激性
4、維持細胞正常的物質代謝
多種無機離子作為金屬酶或金屬活化酶的輔助因子,在細胞水平對物質代謝進行調節。
固體電解質應用
和液態電解質相比,固體電解質的特點在於能夠具有一定的形狀和強度,而且由傳導機理所決定,通常其傳導離子比較單一,離子傳導性具有很強的選擇性。因此,它的應用往往也體現出這些特點。應用方面大致有:
1、用於各種化學電源,如高能密度電池,微功率電池,高溫燃料電池等;
2、用於各種電化學感測器,如控制燃燒的氧感測器,用於環保的氣體感測器,用於金屬熔煉的定氧測頭等等;
3、用於製作各種電化學器件,如積分元件,微庫侖計,計時元件,記憶元件等;
4、用於電化學催化,如對碳氫化合物的加氫反應等;
5、用於物質分離和提純,如金屬鈉的提純,氧的分離等;
6、做成離子選擇電極,用於物理化學研究,如活度測定、擴散係數測定等;
7、用作發熱元件。
高分子電解質的應用
1、絮凝劑
高分子電解質具有絮凝作用,是有效的高分子絮凝劑,其帶電部位能中和膠體粒子電荷,破壞膠體粒子在水中穩定性,促使其碰撞,通過高分子長鏈架橋把許多細小顆粒纏結在一起,聚集成大粒子,從而加速沉降。其絮凝和沉降速度快、污泥脫水效率高,對某些廢水的處理有特效。高分子電解質的絮凝能力,比無機絮凝劑如明礬、氯化鐵等大數倍至數十倍,而且具有許多無機絮凝劑所沒有的獨特性能。
2、在造紙工業的應用
隨著合成高分子工業的發展,高分子電解質作為造紙助劑在造紙工業中的應用日益廣泛,併發揮重要作用。例如,季鏤化聚丙烯醯胺、陽離子澱粉、聚乙烯亞胺等可用作乾濕增強劑,以提高紙張的乾濕強度;羧甲基纖維素、陽離子澱粉是紙張表面的施膠劑,同時亦可增加填料及增白劑的留著率;陽離子聚丙烯醯胺可絮凝沉降水中懸浮的微細纖維,具有絮凝捕集作用,以達到回收紙機排放水中流失的纖維素和填料及澄清水的目的。
3、在石油工業的應用
用做黏土穩定劑、壓裂添加劑的聚合物、緩蝕劑等等。
