平板菌落計數法
檢驗食品衛生質量的優劣的方法
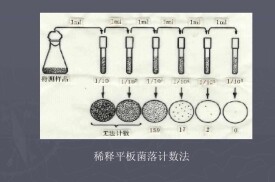
平板菌落計數法,是種統計物品含菌數的有效方法。方法如下:將待測樣品經適當稀釋之後,其中的微生物充分分散成單個細胞,取一定量的稀釋樣液塗布到平板上,經過培養,由每個單細胞生長繁殖而形成肉眼可見的菌落,即一個單菌落應代表原樣品中的一個單細胞;統計菌落數,根據其稀釋倍數和取樣接種量即可換算出樣品中的含菌數。
由於待測樣品往往不宜完全分散成單個細胞,所以,長成的一個單菌落也可能來自樣品中的2~3或更多個細胞。因此平板菌落計數的結果往往偏低。為了清楚地闡述平板菌落計數的結果,現在已傾向使用菌落形成單位(cfu :colony-forming units),而不以絕對菌落數來表示樣品的活菌含量。
菌落是指細菌在固體培養基上生長繁殖而形成的能被肉眼識別的生長物,它是由數以萬計相同的細菌集合而成。當樣品被稀釋到一定程度,與培養基混合,在一定培養條件下,每個能夠生長繁殖的細菌細胞都可以在平板上形成一個可見的菌落。
菌落總數就是指在一定條件下(如需氧情況、營養條件、pH、培養溫度和時間等)每克(每毫升)檢樣所生長出來的細菌菌落總數。按國家標準方法規定,即在需氧情況下,37℃培養48h,能在普通營養瓊脂平板上生長的細菌菌落總數,所以厭氧或微需氧菌、有特殊營養要求的以及非嗜中溫的細菌,由於現有條件不能滿足其生理需求,故難以繁殖生長。因此菌落總數並不表示實際中的所有細菌總數,菌落總數並不能區分其中細菌的種類,所以有時被稱為雜菌數,需氧菌數等。
菌落總數測定是用來判定食品被細菌污染的程度及衛生質量,它反映食品在生產過程中是否符合衛生要求,以便對被檢樣品做出適當的衛生學評價。菌落總數的多少在一定程度上標誌著食品衛生質量的優劣。
菌落總數的測定,一般將被檢樣品製成幾個不同的10倍遞增稀釋液,然後從每個稀釋液中分別取出1mL置於滅菌平皿中與營養瓊脂培養基混合,在一定溫度下,培養一定時間后(一般為48小時),記錄每個平皿中形成的菌落數量,依據稀釋倍數,計算出每克(或每ml)原始樣品中所含細菌菌落總數。
基本操作一般包括:樣品的稀釋--傾注平皿--培養48小時--計數報告。
國內外菌落總數測定方法基本一致,從檢樣處理、稀釋、傾注平皿到計數報告無何明顯不同,只是在某些具體要求方面稍有差別,如有的國家在樣品稀釋和傾注培養進,對吸管內液體的流速,稀釋液的振蕩幅度、時間和次數以及放置時間等均作了比較具體的規定。
檢驗方法參見:
GB4789.2-94 《中華人民共和國國家標準 食品衛生微生物學檢驗 菌落總數測定》
SN0168-92 《中華人民共和國進出口商品檢驗行業標準 出口食品菌落計數》
1.操作方法:以無菌操作取檢樣25g(或25ml),放於225mL滅菌生理鹽水或其他稀釋液的滅菌玻璃瓶內(瓶內預置適當數量的玻璃珠)或滅菌乳缽內,經充分振搖或研磨製成1:10的均勻稀釋液。
固體檢樣在加入稀釋液后,最好置滅菌均質器中以8000~10000r/min的速度處理1min,製成1:10的均勻稀釋液。
另取1ml滅菌吸管,按上項操作順序,制10倍遞增稀釋液,如此每遞增稀釋一次即換用1支1ml滅菌吸管。
3.採樣的代表性:如系固體樣品,取樣時不應集中一點,宜多采幾個部位。固體樣品必須經過均質或研磨,液體樣品須經過振搖,以獲得均勻稀釋液。
4.樣品稀釋誤差:為減少樣品稀釋誤差,在連續遞次稀釋時,每一稀釋液應充分振搖,使其均勻,同時每一稀釋度應更換一支吸管。
在進行連續稀釋時,應將吸管內液體沿管壁流入,勿使吸管尖端伸入稀釋液內,以免吸管外部粘附的檢液溶於其內。
為減少稀釋誤差,SN標準採用取10mL稀釋液,注入90mL緩衝液中。
1.操作方法:根據標準要求或對污染情況的估計,選擇2~3個適宜稀釋度,分別在制10倍遞增稀釋的同時,以吸取該稀釋度的吸管移取1ml稀釋液於滅菌平皿中,每個稀釋度做兩個平皿。
將涼至46℃營養瓊脂培養基注入平皿約15ml,並轉動平皿,混合均勻。同時將營養瓊脂培養基傾入加有1ml稀釋液(不含樣品)的滅菌平皿內作空白對照。
待瓊脂凝固后,翻轉平板,置36±1℃溫箱內培養48±2h,取出計算平板內菌落數目,乘以稀釋倍數,即得每克(每毫升)樣品所含菌落總數。
2.傾注用培養基應在46℃水浴內保溫,溫度過高會影響細菌生長,過低瓊脂易於凝因而不能與菌液充分混勻。如無水浴,應以皮膚感受較熱而不燙為宜。
傾注培養基的量規定不一,從12~20ml不等,一般以15ml較為適宜,平板過厚可影響觀察,太薄又易於乾裂。傾注時,培基底部如有沉澱物,應將底部棄去,以免與菌落混淆而影響計數觀察。
3.為使菌落能在平板上均勻分佈,檢液加入平皿后,應儘快傾注培養基並旋轉混勻,可正反兩個方向旋轉,檢樣從開始稀釋到傾注最後一個平皿所用時間不宜超過20min,以防止細菌有所死亡或繁殖。。
4.培養溫度一般為37℃(水產品的培養溫度,由於其生活環境水溫較低,故多採用30℃)。培養時間一般為48h,有些方法只要求24h的培養即可計數。培養箱應保持一定的濕度,瓊脂平板培養48h后,培養基失重不應超過15%。
5.為了避免食品中的微小顆粒或培基中的雜質與細菌菌落發生混淆,不易分辨,可同時作一稀釋液與瓊脂培基混合的平板,不經培養,而於4℃環境中放置,以便計數時作對照觀察。
在某些場合,為了防止食品顆粒與菌落混淆不清,可在營養瓊脂中加入氯化三苯四氮唑(TTC),培養后菌落呈紅色,易於分別。
1.操作方法:培養到時間后,計數每個平板上的菌落數。可用肉眼觀察,必要時用放大鏡檢查,以防遺漏。在記下各平板的菌落總數后,求出同稀釋度的各平板平均菌落數,計算處原始樣品中每克(或每ml)中的菌落數,進行報告。
2.到達規定培養時間,應立即計數。如果不能立即計數,應將平板放置於0-4℃,但不得超過24h。
3.計數時應選取菌落數在30~300之間的平板(SN標準要求為25~250個菌落),若有二個稀釋度均在30~300之間時,按國家標準方法要求應以二者比值決定,比值小於或等於2取平均數,比值大於2則其較小數字(有的規定不考慮其比值大小,均以平均數報告)。
4.若所有稀釋度均不在計數區間。如均大於300,則取最高稀釋度的平均菌落數乘以稀釋倍數報告之。如均小於30,則以最低稀釋度的平均菌落數乘稀釋倍數報告之。如菌落數有的大於300,有的又小於30,但均不在30~300之間,則應以最接近300或30的平均菌落數乘以稀釋倍數報告之。如所有稀釋度均無菌落生長,則應按小於1乘以最低稀釋倍數報告之。有的規定對上述幾種情況計算出的菌落數按估算值報告。
5.不同稀釋度的菌落數應與稀釋倍數成反比(同一稀釋度的二個平板的菌落數應基本接近),即稀釋倍數愈高菌落數愈少,稀釋倍數愈低菌落數愈多。如出現逆反現象,則應視為檢驗中的差錯(有的食品有時可能出現逆反現象,如酸性飲料等),不應作為檢樣計數報告的依據。
6.當平板上有鏈狀菌落生長時,如呈鏈狀生長的菌落之間無任何明顯界限,則應作為一個菌落計,如存在有幾條不同來源的鏈,則每條鏈均應按一個菌落計算,不要把鏈上生長的每一個菌落分開計數。如有片狀菌落生長,該平板一般不宜採用,如片狀菌落不到平板一半,而另一半又分佈均勻,則可以半個平板的菌落數乘2代表全平板的菌落數。
7.當計數平板內的菌落數過多(即所有稀釋度均大於300時),但分佈很均勻,可取平板的一半或1/4計數。再乘以相應稀釋倍數作為該平板的菌落數。