NF-κB
NF-κB
核因子κB(nuclear factor kappa-B,NF-κB)蛋白最早由David Baltimore發現,該蛋白家族可以選擇性的結合在B細胞κ-輕鏈增強子上調控許多基因的表達。在幾乎所有的動物細胞中都能發現NF-κB,它們參與細胞對外界刺激的響應,如細胞因子、輻射、重金屬、病毒等。在細胞的炎症反應、免疫應答等過程中NF-κB起到關鍵性作用。NF-κB的錯誤調節會引發自身免疫病、慢性炎症以及很多癌症。NF-κB也與突觸的可塑性、記憶有關。
NF-κB
NF-κB結合DNA的結構最早是在成熟B細胞免疫球蛋白κ-輕鏈基因的增強子上被發現,兩個亞基形成的同源和/或異源二聚體與靶基因上10bp特定的序列(-κB 位點)結合調節基因轉錄,不同的NF-κB二聚體在選擇結合序列時可能略有差異,這是NF-κB通過不同的二聚體的形式對不同基因的表達進行精細調節的一種方式,但結合的模式基本相同。NF-κB的兩個RHR組裝成蝴蝶樣結構,中間有一個孔可以讓DNA穿過。CTD負責兩個蛋白的二聚,以及DNA的磷酸化,NTD可以特異性識別DNA鹼基序列以及非特異性結合DNA的磷酸骨架。
最常見的NF-κB二聚體是RelA(p65)與 p50組成的異二聚體。
NF-κB二聚體的抑制蛋白家族(IκB)包含傳統的IκB蛋白(IκBα,IκBβ,IκBε),NF-κB前體蛋白(p100,p105),以及核IκB(IκBζ , Bcl-3, and IκBNS)。
IκB通過其C末端特定的錨蛋白重複序列(ankyrin repeat–containing domain ,ARD)與NF-κB結合,並覆蓋NLS阻止NF-κB向細胞核內轉移。
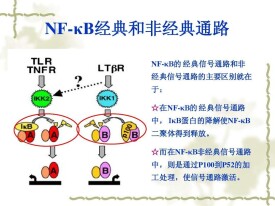
由於在其C末端半部存在錨蛋白重複,p105和p100也起IκB蛋白的作用。p100的c-末端一半(通常稱為IκBδ)也起抑製劑的作用。IκBδ響應發育刺激而降解,例如通過LTβR轉導的刺激,在NIK依賴的非經典途徑中加強NF-κB二聚體活化。
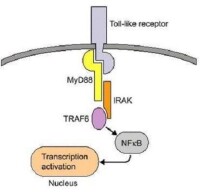
NF-κB信號通路
NF-κB在調節細胞反應中是相當重要的,因為它屬於“快速作用”的初級轉錄因子,不需要新的蛋白質合成就能被激活(有該特性的其他成員包括c-Jun,STAT和核激素受體)。NF-κB是對有害細胞刺激的第一反應者。已知的NF-κB通路激活因子有很多,包括:TNF-α、IL-1β、IL-2、IL-6、IL-8、IL-12、iNOS、COX2、趨化因子、粘附分子、集落刺激因子等。此外,鋅指蛋白A20、血紅素加氧酶-1 (HO-1)等一些抗炎和與細胞凋亡有關的分子如:腫瘤壞死因子受體相關因子-1(tumour-necrosis factor receptor associated factor -1,TRAF-1),抗細胞凋亡的蛋白-1和-2(inhibitor of apoptosis 1/2 , IAP1/ IAP2),TNF 受體相關因子(receptor–associated factors ,TRAF1 /TRAF2),Bcl-2 同源體 A1/Bfl-1和 IEX-IL也都受NF-κB的調控。
NF-κB受體激活劑(RANK)是一種TNFR,是NF-κB的中樞激活劑。骨保護劑(OPG)是RANK配體(RNAK ligand,RNAKL)的誘餌受體同系物,通過結合RANKL來抑制RANK,因此骨保護素與NF-κB的調控緊密相關。
許多細菌的代謝產物和各種表面受體的活化導致NF-κB通路的激活,快速改變基因的表達。Toll樣受體(Toll-like receptors,TLRs)作為一種特殊的識別分子,它對NF-κB通路的激活增加了我們對不同病原體激活NF-κB通路的理解。TLR是先天性和適應性免疫應答的關鍵調節因子。