碳酸酐酶
含鋅金屬酶之一
碳酸酐酶(Carbonic Anhydrase,CA)是一種含鋅金屬酶,迄今在哺乳動物體內已發現至少有11種同工酶,它們的結構、分佈、性質各異,多與各種上皮細胞泌H-和碳酸氫鹽有關,通過催化CO2水化反應及某些脂、醛類水化反應,參與多種離子交換,維持機體內環境穩態。
1940年發現的第一個鋅酶,也是最重要的鋅酶。現已報道有80多種鋅酶,居各類金屬的首位。分佈於人體內的腎小管上皮細胞、胃黏膜、胰腺、紅細胞、中樞神經細胞和睫狀體上皮細胞等組織中。
在人類和動物的血液當中,碳酸酐酶是紅細胞中主要的蛋白質成分之一,它的重要性地位和含量上都僅次於血紅蛋白。
碳酸酐酶(Carbonic Anhydrase,CA)是一種含鋅金屬酶,有多種同工酶,都具有催化作用,參與多種離子交換,維持機體內環境穩態。
CA分佈廣泛。CAⅠ、Ⅱ從紅細胞首次分離得到。CAⅢ最早發現於骨骼肌細胞漿,三者在人類都是29kD的胞漿內酶;膜相關酶CAⅣ已於小牛肺、人腎、大鼠肺中純化出來;CAⅣ(29kD)發現於線粒體;由Murakmi於1987年從唾液腺中純化的CAⅥ(42kD)為分泌型酶;近期在唾液腺及小腦浦肯野氏細胞中發現的新CA相關基因CAⅧ亦為胞漿內酶。胃腸道、腎遠曲小管和集台管、腎上腺球狀帶細胞、附睾起始段狹窄細胞、遠側頭體部和近側尾部上皮細胞、快收縮骨骼肌細胞、腦脈絡叢上皮細胞、髓磷脂形成細胞及眼部睫狀突、角膜、視網膜細胞內都有CAⅡ;CAⅣ還分佈於胃腸道、腎遠曲小管和髓袢升支粗段上皮細胞頂質膜、基側質膜表面、附睾、輸精管及其壺腹部的上皮微絨毛、頂質膜、皮下平滑肌層、腦毛細血管上皮細胞腔面、心肌、眼部分毛細血管床、脈絡膜血管層以及骨骼肌、肝、淚腺等處。
碳酸酐酶
碳酸酐酶是紅細胞的主要蛋白質成分之一,在紅細胞中的地位僅次於血紅蛋白。含一條捲曲的蛋白質鏈和一個鋅(Ⅱ)離子。分子量約為30000。鋅離子處於變形四面體的配位環境。催化的最重要的反應是二氧化碳(碳酸酐)可逆的水合作用,使它在生理pH值條件(pH值≌7)下很快進行。為催化CO2(g) + H2O → H2CO3反應的酶,酶加速二氧化碳水合的因子在10^7左右。上述反應對呼吸作用極為重要。
碳酸酐酶是鋅蛋白質(動物原性),存在於脊椎動物的紅血球和許多動物的各種組織以及植物的葉中。它在紅血球中具有對碳酸和重碳酸離子的迅速轉換的作用。在胃中對鹽酸的分泌起作用,一般來說,具有調節體液pH的作用。另外認為與植物的光合作用有關係。
1.在血液及其他組織中維持酸鹼平衡。
2.幫助體內組織排除二氧化碳。
3.確保以CO2和HCO3-為催化底物的酶保持適度的底物濃度。
4.在植物體內,CA可以幫助提高葉綠體內CO2的濃度,從而增加二磷酸核酮糖羧化酶的羧化率。
5. 產甲烷菌中,CA則參與醋酸鹽的分解代謝。
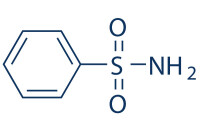
CA的主要抑製劑為磺胺類,表面活性劑如DDT抑制CA的作用可能與使基團解離異化有關。不同的CA對磺胺類抑製劑敏感性不同,研究CAⅡ198位變異種與抑製劑的結合力發現,198位殘基側鏈的電荷、疏水性和藥物親和力有關CAⅢ198位上的苯丙氨酸側鏈上的苯基填塞了疏水“袋”,造成低催化、低敏感性。此外,表面活性劑可抑制CA在高濃度下生成聚合體,因而減少聚合體對CA復性蛋白形成的競爭性抑制,促進了蛋白再摺疊的啟動階段,最終擴大了CA的活性濃度範圍。
Chen等(1991)的研究表明雌二醇E2對CA有一定作用,且作用隨組織不同而異:大鼠十二指腸粘膜上的CA可在E影響下降低活性,而大鼠腎中CA在E2作用下雖有下降趨勢,但無明顯差異。同年,Pirkko等的實驗發現閹割的大鼠前列腺旁側CAⅡ蛋白和mRNA水平下降,其背側則相反;用睾酮處理后此變化可逆轉;用處理后旁側變化逆轉,而對背側無影響;未閹割的大鼠用處理髮現背側CAⅠ水平升高而旁側CAⅡ無變化碳酸酐酶的基本結構、大體分佈、基本生理功能早在60年代已為人類初步認識,隨著分子生物學技術的廣泛應用,近期研究側重於CA結構與功能問關係的探索,CA的結構、功能、分佈的認識將進一步具體化。
CA在睫狀體上皮細胞中催化CO2和H2O生成HCO3,透過腔膜分泌於房水,由於房水中的液體要保持電中性,Na+向房水分泌增加,同時帶動Cl-向房水移動,從而使房水形成高滲壓,於是促進H2O向房水流動;保持房水平衡和正常的pH值。而青光眼病人由於房水迴流不暢,引起眼壓升高。CA抑製劑(CAIs)可抑制CA的活性,使HCO3生成減少而降低眼壓,臨床上主要用於治療青光眼,降低眼壓。
CAIs作為治療青光眼的藥物,按其發展過程和藥理作用分為三代:第一代口服CAIs,第二代局部用CAIs,第三代長效無刺激局部用CAIs。
第一代口服CAIs乙醯唑胺是首先用於青光眼的口服治療藥物,由於脂溶性低,眼內分佈較少,需用較大劑量(1000-2000毫克)才有效,因而白葯濃度較高;長期用藥易出現低血鉀和代謝性酸中毒(高氯血症性酸中毒),因此臨床應用日漸減少。口服CAIs對非眼組織CA的抑制,會產生嚴重的全身不良反應。用藥初期出現多尿、胃腸不適和疲勞,部分病人發生腎結石,極少數病例發生粒細胞缺乏症。
第二代局部用CAIs20世紀90年代初合成了多爾唑胺和布林唑胺。其具有較強的選擇性抑制CA活性和較高的水溶性與脂溶性,便於配製滴眼液,能透過角膜,使藥物在睫狀體達到有效藥物濃度。1995年,多爾唑胺滴眼液在德國上市,無全身不良反應。但由於水溶液pH值為5.5,對眼結膜有輕度刺激性。布林唑胺於1998年上市,其水溶性較差,故配製成混懸液。其抑制CA的作用強於多爾唑胺,對眼的刺激較輕。且作用時間短,只能維持2-3個小時,每天需要多次用藥才能保持有效的藥物濃度.
第三代長效無刺激局部用CAIs科研人員對CAIs化合物的結構進行改造后,獲得兩個強效、作用時間較長(5-6小時)的CAIs,但配製成滴服液的pH值為5.5左右,對眼仍有刺激。為解決pH問題,科研人員將化合物尾部的雙羧基改換為氨基酸,使其滴服液的pH值在6.5-7之間,對眼的刺激基本消除。至此,第三代CAIs的雛形已基本形成。