線粒體
生物學術語
線粒體(mitochondrion) 是一種存在於大多數細胞中的由兩層膜包被的細胞器,是細胞中製造能量的結構,是細胞進行有氧呼吸的主要場所,被稱為"power house"。其直徑在0.5到1.0微米左右。
除了溶組織內阿米巴、籃氏賈第鞭毛蟲以及幾種微孢子蟲外,大多數真核細胞或多或少都擁有線粒體,但它們各自擁有的線粒體在大小、數量及外觀等方面上都有所不同。
線粒體擁有自身的遺傳物質和遺傳體系,但其基因組大小有限,是一種半自主細胞器。除了為細胞供能外,線粒體還參與諸如細胞分化、細胞信息傳遞和細胞凋亡等過程,並擁有調控細胞生長和細胞周期的能力。
線粒體(mitochondrion)是細胞中製造能量的結構,科學界也給線粒體起了一個別名叫做“power house”,即細胞的發電廠。一個細胞內含有線粒體的數目可以從十幾個到數百個不等,越活躍的細胞含有的線粒體數目越多,如時刻跳動的心臟細胞和經常思考問題的大腦細胞含有線粒體的數目最大,皮膚細胞含有線粒體的數目比較少。
科學家發現農民皮膚細胞的線粒體因常年在室外勞動受到損傷的程度遠遠高於其他室內職業者,線粒體受到損傷,細胞就會缺乏能量而死亡。我們的面部常年暴露在外,時時刻刻都在經受風吹雨打和各種污染顆粒的侵襲,因此面部細胞經常是因為過度的磨難而早夭。
線粒體是1850年發現的,1898年命名。線粒體由兩層膜包被,外膜平滑,內膜向內摺疊形成嵴,兩層膜之間有腔,線粒體中央是基質。基質內含有與三羧酸循環所需的全部酶類,內膜上具有呼吸鏈酶系及ATP酶複合體。線粒體是細胞內氧化磷酸化和形成ATP的主要場所,有細胞"動力工廠"(powerplant)之稱。另外,線粒體有自身的DNA和遺傳體系,但線粒體基因組的基因數量有限,因此,線粒體只是一種半自主性的細胞器。
在多數細胞中,線粒體均勻分佈在整個細胞質中,但在某些些細胞中,線粒體的分佈是不均一的,有時線粒體聚集在細胞質的邊緣。在細胞質中,線粒體常常集中在代謝活躍的區域,因為這些區域需要較多的ATP,如肌細胞的肌纖維中有很多線粒體。另外,在精細胞、鞭毛、纖毛和腎小管細胞的基部都是線粒體分佈較多的地方。線粒體除了較多分佈在需要ATP的區域外,也較為集中的分佈在有較多氧化反應底物的區域,如脂肪滴,因為脂肪滴中有許多要被氧化的脂肪。
線粒體基因組
線粒體基因組中基因的數量很少,規模遠小於細菌基因組。但內共生學說認為線粒體源於被吞噬的細菌,那麼兩者基因組規模應該較為相似。為了解釋這一現象,有猜想認為原線粒體的基因除了丟失了一些外,大部分轉移到了宿主細胞的細胞核中,所以核基因編碼了在超過98%的線粒體表達內的蛋白質。某些有線粒體,但線粒體中不含DNA的生物(如隱孢子蟲等)的mtDNA可能已完全丟失或整合入核DNA中。線粒體DNA(mtDNA)在線粒體中有2-10個備份,呈雙鏈環狀(但也有呈線狀的特例存在)。mtDNA長度一般為幾萬至數十萬鹼基對,人類mtDNA的長度為16,569bp,擁有有37個基因,編碼了兩種rRNA(12S rRNA和16S rRNA)、22種tRNA(同樣轉運20種標準氨基酸,只是亮氨酸和絲氨酸都有兩種對應的tRNA)以及13種多肽(呼吸鏈複合物Ⅰ、Ⅲ、Ⅳ、Ⅴ的亞基)。mtDNA的長度和線粒體基因組的大小因物種而異,表一列出了幾種模式生物mtDNA的長度:
| 表一:幾種模式生物mtDNA的長度 | ||
| 生物 | 學名 | mtDNA長度(bp) |
|---|---|---|
| 芽殖酵母 | Saccharomyces cerevisiae | 85779 |
| 裂殖酵母 | Schizosaccharomyces pombe | 19431 |
| 擬南芥 | Arabidopsis thaliana | 366924 |
| 水稻 | Oryza sativa | 490520 |
| 秀麗隱桿線蟲 | Caenorhabditis elegans | 13794 |
| 黑腹果蠅 | Drosophila melanogaster | 19517 |
| 非洲爪蟾 | Xenopus laevis | 17553 |
| 小鼠 | Mus musculus | 16300 |
mtDNA利用率極高,線粒體基因組各基因之間排列十分緊湊,部分區域還可能出現重疊(即前一個基因的最後一段鹼基與下一個基因的第一段鹼基相銜接)。人類mtDNA中基因間隔區總共只有87bp,佔mtDNA總長的0.5%。mtDNA的兩條DNA單鏈均有編碼功能,其中重鏈編碼兩個rRNA、12個mRNA和14個tRNA;輕鏈編碼一個mRNA和8個tRNA。mtDNA一般沒有內含子(如人類的mtDNA等),但也已發現某些真核生物的mtDNA擁有內含子,這些生物包括:盤基網柄菌等原生生物和酵母菌(其OXi3基因有9個內含子)。這些mtDNA中的內含子在基因轉錄產物的加工和翻譯中可能有一定功能。
線粒體基因組通常都是存在於同一個mtDNA分子中,但少數生物的線粒體基因組卻分別儲存在多個不同的mtDNA中。例如,人虱的線粒體基因組就分開儲藏於18個長約3-4kb的微型環狀DNA中,每個DNA分子只分配到了1-3個基因。這些微型環狀DNA之間也存在著同源或非同源的基因重組現象,但成因未知。
2019年3月,發表在PNAS《美國科學院院刊》上的研究表明,線粒體可由父系遺傳。來自美國辛辛那提兒童醫院的黃濤生博士和梅奧診所的Paldeep Atwal博士稱他們在三個家庭中發現了mtDNA雙親遺傳。傳統觀念里,大多數哺乳動物的線粒體和線粒體DNA都是只通過母系遺傳。儘管有其他物種已被發現線粒體偶爾會經歷父系遺傳,但之前關於人類父系遺傳線粒體的報道大多是因為污染或樣本混淆。然而,2019年美國的實驗室發表論文,稱他們在三個家庭中發現了mtDNA雙親遺傳。研究人員還在獨立實驗室中通過不同方法證實了他們的成果。
線粒體中擁有一套獨特的遺傳系統。在進行人類線粒體遺傳學研究時,人們確認線粒體的遺傳密碼與通用遺傳密碼也有些許差異。自從上述發現證明並不只存在單獨的一種遺傳密碼之後,許多有輕微不同的遺傳密碼都陸續連發現。在線粒體的遺傳密碼中最常見的差異是:AUA由終止密碼子變為甲硫氨酸的密碼子、UGA由終止密碼子變為色氨酸的密碼子、AGA和AGG由精氨酸的密碼子變為終止密碼子(植物等生物的線粒體遺傳密碼另有差異,參見表二)。此外,也有某些特例是只涉及終止密碼子的,在山羊支原體線粒體遺傳密碼的UGA由終止密碼子變為色氨酸的密碼子,而且使用頻率比UGG更高;四膜蟲線粒體遺傳密碼里只有UGA一種終止密碼子,其UAA和UAG由終止密碼子變為谷氨醯胺的密碼子;而游仆蟲線粒體遺傳密碼里則只有UAA和UAG兩種終止密碼子,其UGA由終止密碼子變為半胱氨酸的密碼子。通過線粒體遺傳密碼和通用遺傳密碼的對比,可以推導出遺傳密碼演化過程的可能模式。
| 表二:線粒體遺傳密碼與通用遺傳密碼的差異 | |||||
| 密碼子 | 通用密碼 | 線粒體遺傳密碼 | |||
| 真菌 | 植物 | 無脊椎動物 | 哺乳動物 | ||
| UGA | 終止密碼子 | 色氨酸 | 終止密碼子 | 色氨酸 | 色氨酸 |
| AUA | 異亮氨酸 | 甲硫氨酸 | 異亮氨酸 | 甲硫氨酸 | 甲硫氨酸 |
| CUA | 亮氨酸 | 蘇氨酸 | 亮氨酸 | 亮氨酸 | 亮氨酸 |
| AGA、AGG | 精氨酸 | 精氨酸 | 精氨酸 | 絲氨酸 | 終止密碼子 |
分裂與融合
線粒體的融合是與分裂協同進行的,過程高度保守,需要在多種蛋白質的精確調控下完成。兩者一般保持動態平衡,這種平衡對維持線粒體正常的形態、分佈和功能十分重要。線粒體融合與分裂間的失衡可產生巨型線粒體,這種過大的線粒體常見於病變的肝細胞、惡性營養不良患者的胰臟細胞和白血病患者骨髓的巨噬細胞中。分裂異常會導致線粒體破碎,而融合異常則會導致線粒體形態延長,兩者都會影響線粒體的功能。分裂與融合活動異常的線粒體膜電位通常會降低,並最終經線粒體自噬作用清除。
線粒體的分裂在真核細胞內經常發生。為了保證在細胞發生分裂后每個子細胞都能繼承母細胞的線粒體,母細胞中的線粒體在一個細胞周期需要至少複製一次。即使是在不再分裂的細胞內,線粒體為了填補已老化的線粒體造成的空缺也需要進行分裂。的線粒體以與細菌的無絲分裂類似的方式進行增殖,可細分為三種模式:
間壁分離(見於部分動物和植物線粒體):線粒體內部首先由內膜形成隔,隨後外膜的一部分內陷,插入到隔的雙層膜之間,將線粒體一分為二。
收縮分離(見於蕨類植物和酵母菌線粒體):線粒體中部先縊縮同時向兩端不斷拉長然後一分為二。
出芽分離(見於蘚類植物和酵母菌線粒體):線粒體上先出現小芽,小芽脫落後成長、發育為成熟線粒體。
線粒體的融合也是細胞中的基本事件,對線粒體正常功能的發揮具有非常重要的作用。人類細胞需要通過線粒體融合的互補作用來抵抗衰老;酵母細胞線粒體融合發生障礙會引起呼吸鏈缺陷。線粒體間的融合需在一種分子量約為800kDa的蛋白質複合物——“融合裝置”(fusion machinery)的介導下進行,該過程可大致分為四個步驟:錨定、外膜融合、內膜融合以及基質內含物融合。
群體遺傳學
因為mtDNA幾乎不發生基因重組,所以遺傳學家長期將其作為研究群體遺傳學與進化生物學的信息來源。所有mtDNA是以單一單元(單體型)進行遺傳的(而不像細胞核中的DNA儲存在多個染色體中),它們在親本與子代之間的傳遞關係並不複雜,因此不同個體間mtDNA的聯繫便可以利用系統發生樹來表現。而從這些系統發生樹的形態中人們可以得知種群的進化史。人類進化遺傳學中運用分子鐘技術推算出了線粒體夏娃最晚出現的時間(這個成果被認為是人類由非洲單地起源的有力依據)是利用mtDNA研究群體遺傳學的典型例子。另外一個例子是對尼安德特人骨骼化石中mtDNA測序。該測序的結果顯示,尼安德特人與解剖學意義上的現代人在mtDNA序列上有較大差異,說明兩者間缺乏基因交流。雖然mtDNA在遺傳學研究中佔據了重要地位,但是mtDNA序列中的信息只能反映所考察的群體中的雌性成員的演化進程,而不能代表整個種群。這一缺陷需要由對父系遺傳序列(如Y染色體上的非重組區)的測序彌補。廣義上來說,只有既考慮了mtDNA又考慮了核DNA的遺傳學研究才能為種群的進化史提供全面的線索。
線粒體結構
大小
線粒體是一些大小不一的球狀、棒狀或細絲狀顆粒,一般為0.5~1.0μm,長1~2μm,在光學顯微鏡下,需用特殊的染色,才能加以辨別。在動物細胞中,線粒體大小受細胞代謝水平限制。不同組織在不同條件下可能產生體積異常膨大的線粒體,稱為“巨線粒體”(megamitochondria):胰臟外分泌細胞中可長達10~20μm;神經元胞體中的線粒體尺寸差異很大,有的也可能長達10μm;人類成纖維細胞的線粒體則更長,可達40μm。有研究表明在低氧氣分壓的環境中,某些如煙草的植物的線粒體能可逆地變為巨線粒體,長度可達80μm,並形成網路。
形狀
線粒體一般呈短棒狀或圓球狀,但因生物種類和生理狀態而異,還可呈環狀、線狀、啞鈴狀、分杈狀、扁盤狀或其它形狀。成型蛋白(shape-forming protein)介導線粒體以不同方式與周圍的細胞骨架接觸或在線粒體的兩層膜間形成不同的連接可能是線粒體在不同細胞中呈現出不同形態的原因。
數量
不同生物的不同組織中線粒體數量的差異是巨大的。有許多細胞擁有多達數千個的線粒體(如肝臟細胞中有1000~2000個線粒體),而一些細胞則只有一個線粒體(如酵母菌細胞的大型分支線粒體)。大多數哺乳動物的成熟紅細胞不具有線粒體。一般來說,細胞中線粒體數量取決於該細胞的代謝水平,代謝活動越旺盛的細胞線粒體越多。
分佈
線粒體分佈方向與微管一致,通常分佈在細胞功能旺盛的區域:如在腎臟細胞中靠近微血管,呈平行或柵狀排列;在腸表皮細胞中呈兩極分佈,集中在頂端和基部;在精子中分佈在鞭毛中區。在卵母細胞體外培養中,隨著細胞逐漸成熟,線粒體會由在細胞周邊分佈發展成均勻分佈。線粒體在細胞質中能以微管為導軌、由馬達蛋白提供動力向功能旺盛的區域遷移。
結構
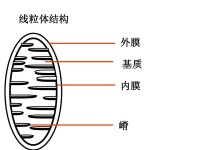
線粒體由外至內可劃分為線粒體外膜(OMM)、線粒體膜間隙、線粒體內膜(IMM)和線粒體基質四個功能區。處於線粒體外側的膜彼此平行,都是典型的單位膜。其中,線粒體外膜較光滑,起細胞器界膜的作用;線粒體內膜則向內皺褶形成線粒體嵴,負擔更多的生化反應。這兩層膜將線粒體分出兩個區室,位於兩層線粒體膜之間的是線粒體膜間隙,被線粒體內膜包裹的是線粒體基質。
組成
線粒體的化學組分主要包括水、蛋白質和脂質,此外還含有少量的輔酶等小分子及核酸。蛋白質佔線粒體乾重的65%~70%。線粒體中的蛋白質既有可溶的也有不溶的。可溶的蛋白質主要是位於線粒體基質的酶和膜的外周蛋白;不溶的蛋白質構成膜的本體,其中一部分是鑲嵌蛋白,也有一些是酶。線粒體中脂類主要分佈在兩層膜中,占乾重的20%~30%。在線粒體中的磷脂佔總脂質的3/4以上。同種生物不同組織線粒體膜中磷脂的量相對穩定。含豐富的心磷脂和較少的膽固醇是線粒體在組成上與細胞其他膜結構的明顯差別。
線粒體
(out membrane)含40%的脂類和60%的蛋白質,具有孔蛋白(porin)構成的親水通道,允許分子量為5kDa以下的分子通過,1kDa以下的分子可自由通過。標誌酶為單胺氧化酶。
(inner membrane)含100種以上的多肽,蛋白質和脂類的比例高於3:1。心磷脂含量高(達20%)、缺乏膽固醇,類似於細菌。通透性很低,僅允許不帶電荷的小分子物質通過,大分子和離子通過內膜時需要特殊的轉運系統。如:丙酮酸和焦磷酸是利用H+ 梯度協同運輸。線粒體氧化磷酸化的電子傳遞鏈位於內膜,因此從能量轉換角度來說,內膜起主要的作用。內膜的標誌酶為細胞色素c氧化酶。
(intermembrane space)是內外膜之間的腔隙,延伸至嵴的軸心部,腔隙寬約6-8nm。由於外膜具有大量親水孔道與細胞質相通,因此膜間隙的pH值與細胞質的相似。標誌酶為腺苷酸激酶。
(matrix)為內膜和嵴包圍的空間。除糖酵解在細胞質中進行外,其他的生物氧化過程都在線粒體中進行。催化三羧酸循環,脂肪酸和丙酮酸氧化的酶類均位於基質中,其標誌酶為蘋果酸脫氫酶。基質具有一套完整的轉錄和翻譯體系。包括線粒體DNA(mtDNA),70S型核糖體,tRNA 、rRNA、DNA聚合酶、氨基酸活化酶等。基質中還含有纖維絲和電子密度很大的緻密顆粒狀物質,內含Ca2+ 、Mg2+ 、Zn2+ 等離子

發現者
1857年,瑞士解剖學家及生理學家阿爾伯特·馮·科立克在肌肉細胞中發現了顆粒狀結構。另外的一些科學家在其他細胞中也發現了同樣的結構,證實了科立克的發現。德國病理學家及組織學家理查德·阿爾特曼將這些顆粒命名為“原生粒”(bioblast)並於1886年發明了一種鑒別這些顆粒的染色法。阿爾特曼猜測這些顆粒可能是共生於細胞內的獨立生活的細菌。
1898年,德國科學家卡爾·本達因這些結構時而呈線狀時而呈顆粒狀,所以用希臘語中“線”和“顆粒”對應的兩個詞——“mitos”和“chondros”——組成“mitochondrion”來為這種結構命名,這個名稱被沿用至今。一年後,美國化學家萊昂諾爾·米歇利斯開發出用具有還原性的健那綠染液為線粒體染色的方法,並推斷線粒體參與某些氧化反應。這一方法於1900年公布,並由美國細胞學家埃德蒙·文森特·考德里推廣。德國生物化學家奧托·海因里希·沃伯格成功完成線粒體的粗提取且分離得到一些催化與氧有關的反應的呼吸酶,並提出這些酶能被氰化物(如氫氰酸)抑制的猜想。
英國生物學家大衛·基林在1923年至1933年這十年間對線粒體內的氧化還原鏈(redox chain)的物質基礎進行探索,辨別出反應中的電子載體——細胞色素。
沃伯格於1931年因“發現呼吸酶的性質及作用方式”被授予諾貝爾生理學或醫學獎。
1963年M. 和 S. nass發現線粒體DNA(mtDNA)后,人們又在線粒體中發現了RNA、DNA聚合酶、RNA聚合酶、tRNA、核糖體、氨基酸活化酶等進行DNA複製、轉錄和蛋白質翻譯的全套裝備,說明線粒體具有獨立的遺傳體系。
雖然線粒體也能合成蛋白質,但是合成能力有限。線粒體1000多種蛋白質中,自身合成的僅十餘種。線粒體的核糖體蛋白、氨醯tRNA合成酶、許多結構蛋白,都是核基因編碼,在細胞質中合成后,定向轉運到線粒體的,因此稱線粒體為半自主細胞器。
利用標記氨基酸培養細胞,用氯黴素和放線菌酮分別抑制線粒體和細胞質蛋白質合成的方法,發現人的線粒體DNA編碼的多肽為細胞色素c氧化酶的3個亞基,F0的2個亞基,NADH脫氫酶的7個亞基和細胞色素b等13條多肽。此外線粒體DNA還能合成12S和16S rRNA及22種tRNA。
mtDNA分子為環狀雙鏈DNA分子,外環為重鏈(H),內環為輕鏈(L )。基因排列非常緊湊,除與mtDNA複製及轉錄有關的一小段區域外,無內含子序列。每個線粒體含數個m tDNA,動物mtDNA 約16-20kb,大多數基因由H鏈轉錄,包括2個rRNA,14個tRNA 和12個編碼多肽的mRNA , L鏈編碼另外8個tRNA和一條多肽鏈。mtDNA上的基因相互連接或僅間隔幾個核苷酸序列,一些多肽基因相互重疊,幾乎所有閱讀框都缺少非翻譯區域。很多基因沒有完整的終止密碼,而僅以T或TA結尾,mRNA的終止信號是在轉錄后加工時加上去的。
線粒體在形態,染色反應、化學組成、物理性質、活動狀態、遺傳體系等方面,都很像細菌,所以人們推測線粒體起源於內共生。按照這種觀點,需氧細菌被原始真核細胞吞噬以後,有可能在長期互利共生中演化形成了現在的線粒體。在進化過程中好氧細菌逐步喪失了獨立性,並將大量遺傳信息轉移到了宿主細胞中,形成了線粒體的半自主性。
線粒體遺傳體系確實具有許多和細菌相似的特徵,如:
① DNA為環形分子,無內含子;
② 核糖體為70S型;
③ RNA聚合酶被溴化乙錠抑制不被放線菌素D所抑制;
④ tRNA、氨醯基-tRNA合成酶不同於細胞質中的;
⑤ 蛋白質合成的起始氨醯基tRNA是N-甲醯甲硫氨醯tRNA,對細菌蛋白質合成抑製劑氯黴素敏感對細胞質蛋白合成抑製劑放線菌酮不敏感。
此外哺乳動物mtDNA的遺傳密碼與通用遺傳密碼有以下區別:
① UGA不是終止信號,而是色氨酸的密碼;
② 多肽內部的甲硫氨酸由AUG和AUA兩個密碼子編碼,起始甲硫氨酸由AUG,AUA,AUU和AUC四個密碼子編碼;
③ AGA,AGG不是精氨酸的密碼子,而是終止密碼子,線粒體密碼系統中有4個終止密碼子(UAA,UAG,AGA,AGG)。
mtDNA表現為母系遺傳。其突變率高於核DNA,並且缺乏修復能力。有些遺傳病,如Leber遺傳性視神經病,肌陣攣性癲癇等均與線粒體基因突變有關。
線粒體的增殖是通過已有的線粒體的分裂,有以下幾種形式:
1、間壁分離,分裂時先由內膜向中心皺褶,將線粒體分類兩個,常見於鼠肝和植物產生組織中
2、收縮後分離,分裂時通過線粒體中部縊縮並向兩端不斷拉長然後分裂為兩個,見於蕨類和酵母線粒體中。
3、出芽,見於酵母和蘚類植物,線粒體出現小芽,脫落後長大,發育為線粒體。
線粒體
1、數量的改變 線粒體的平均壽命約為10天。衰亡的線粒體可通過保留的線粒體直接分裂為二予以補充。在病理狀態下,線粒體的增生實際上是對慢性非特異性細胞損傷的適應性反應或細胞功能升高的表現。例如心瓣膜病時的心肌線粒體、周圍血液循環障礙伴間歇性跛行時的骨骼肌線粒體的呈增生現象。
線粒體數量減少則見於急性細胞損傷時線粒體崩解或自溶的情況下,持續約15分鐘。慢性損傷時由於線粒體逐漸增生,故一般不見線粒體減少(甚至反而增多)。此外,線粒體的減少也是細胞未成熟和(或)去分化的表現。
2、大小改變細胞損傷時最常見的改變為線粒體腫大。根據線粒體的受累部位可分為基質型腫脹和嵴型腫脹二種類型,而以前者為常見。基質型腫脹時線粒體變大變圓,基質變淺、嵴變短變少甚至消失。在極度腫脹時,線粒體可轉化為小空泡狀結構。此型腫脹為細胞水腫的部分改變。光學顯微鏡下所謂的濁腫細胞中所見的細顆粒即腫大的線粒體。嵴型腫較少見,此時的腫脹局限於嵴內隙,使扁平的嵴變成燒瓶狀乃至空泡狀,而基質則更顯得緻密。嵴型腫脹一般為可復性,但當膜的損傷加重時,可經過混合型而過渡為基質型。
線粒體為對損傷極為敏感的細胞器,其腫脹可由多種損傷因子引起,其中最常見的為缺氧;此外,微生物毒素、各種毒物、射線以及滲透壓改變等亦可引起。但輕度腫大有時可能為其功能升高的表現,較明顯的腫脹則恆為細胞受損的表現。但只要損傷不過重、損傷因子的作用不過長,腫脹仍可恢復。
線粒體的增大有時是器官功能負荷增加引起的適應性肥大,此時線粒體的數量也常增多,例如見於器官肥大時。反之,器官萎縮時,線粒體則縮小、變少。
3、結構的改變 線粒體嵴是能量代謝的明顯指征,但嵴的增多未必均伴有呼吸鏈酶的增加。嵴的膜和酶平行增多反映細胞的功能負荷加重,為一種適應狀態的表現;反之,如嵴的膜和酶的增多不相平行,則是胞漿適應功能障礙的表現,此時細胞功能並不升高。
在急性細胞損傷時(大多為中毒或缺氧),線粒體的嵴被破壞;慢性亞致死性細胞損傷或營養缺乏時,線粒體的蛋白合成受障,以致線粒體幾乎不再能形成新的嵴。
根據細胞損傷的種類和性質,可在線粒體基質或嵴內形成病理性包含物。這些包含物有的呈晶形或副晶形(可能由蛋白構成),如在線粒體性肌病或進行性肌營養不良時所見,有的呈無定形的電子緻密物,常見於細胞趨於壞死時,乃線粒體成分崩解的產物(脂質和蛋白質),被視為線粒體不可復性損傷的表現。線粒體損傷的另一種常見改變為髓鞘樣層狀結構的形成,這是線粒體膜損傷的結果。
衰亡或受損的線粒體,最終由細胞的自噬過程加以處理並最後被溶酶體酶所降解消化。
線粒體是真核生物進行氧化代謝的部位,是糖類、脂肪和氨基酸最終氧化釋放能量的場所。線粒體負責的最終氧化的共同途徑是三羧酸循環與氧化磷酸化,分別對應有氧呼吸的第二、三階段。細胞質基質中完成的糖酵解和在線粒體基質中完成的三羧酸循環在會產還原型煙醯胺腺嘌呤二核苷酸(reduced nicotinarnide adenine dinucleotide,NADH)和還原型黃素腺嘌呤二核苷酸(reduced flavin adenosine dinucleotide,FADH2)等高能分子,而氧化磷酸化這一步驟的作用則是利用這些物質還原氧氣釋放能量合成ATP。在有氧呼吸過程中,1分子葡萄糖經過糖酵解、三羧酸循環和氧化磷酸化將能量釋放后,可產生30-32分子ATP(考慮到將NADH運入線粒體可能需消耗2分子ATP)。如果細胞所在環境缺氧,則會轉而進行無氧呼吸。此時,糖酵解產生的丙酮酸便不再進入線粒體內的三羧酸循環,而是繼續在細胞質基質中反應(被NADH還原成乙醇或乳酸等發酵產物),但不產生ATP。所以在無氧呼吸過程中,1分子葡萄糖只能在第一階段產生2分子ATP。
糖酵解中生成的每分子丙酮酸會被主動運輸轉運穿過線粒體膜。進入線粒體基質后,丙酮酸會被氧化,並與輔酶A結合生成CO2、還原型輔酶Ⅰ和乙醯輔酶A。乙醯輔酶A是三羧酸循環(也稱為“檸檬酸循環”或“Krebs循環”)的初級底物。參與該循環的酶除位於線粒體內膜的琥珀酸脫氫酶外都遊離於線粒體基質中。在三羧酸循環中,每分子乙醯輔酶A被氧化的同時會產生起始電子傳遞鏈的還原型輔因子(包括3分子NADH和1分子FADH2)以及1分子三磷酸鳥苷(GTP)。
NADH和FADH2等具有還原性的分子(在細胞質基質中的還原當量可從由逆向轉運蛋白構成的蘋果酸-天冬氨酸穿梭系統或通過磷酸甘油穿梭作用進入電子傳遞鏈)在電子傳遞鏈裡面經過幾步反應最終將氧氣還原並釋放能量,其中一部分能量用於生成ATP,其餘則作為熱能散失。在線粒體內膜上的酶複合物(NADH-泛醌還原酶、泛醌-細胞色素c還原酶、細胞色素c氧化酶)利用過程中釋放的能量將質子逆濃度梯度泵入線粒體膜間隙。雖然這一過程是高效的,但仍有少量電子會過早地還原氧氣,形成超氧化物等活性氧(ROS),這些物質能引起氧化應激反應使線粒體性能發生衰退。
當質子被泵入線粒體膜間隙后,線粒體內膜兩側便建立起了電化學梯度,質子就會有順濃度梯度擴散的趨勢。質子唯一的擴散通道是ATP合酶(呼吸鏈複合物V)。當質子通過複合物從膜間隙回到線粒體基質時,電勢能被ATP合酶用於將ADP和磷酸合成ATP。這個過程被稱為“化學滲透”,是一種協助擴散。彼得·米切爾就因為提出了這一假說而獲得了1978年諾貝爾獎。1997年諾貝爾獎獲得者保羅·博耶和約翰·瓦克闡明了ATP合酶的機制。
線粒體可以儲存鈣離子,可以和內質網、細胞外基質等結構協同作用,從而控制細胞中的鈣離子濃度的動態平衡。線粒體迅速吸收鈣離子的能力使其成為細胞中鈣離子的緩衝區。在線粒體內膜膜電位的驅動下,鈣離子可由存在於線粒體內膜中的單向運送體輸送進入線粒體基質;排出線粒體基質時則需要鈉-鈣交換蛋白的輔助或通過鈣誘導鈣釋放(calcium-induced-calcium-release,CICR)機制。在鈣離子釋放時會引起伴隨著較大膜電位變化的“鈣波”(calcium wave),能激活某些第二信使系統蛋白,協調諸如突觸中神經遞質的釋放及內分泌細胞中激素的分泌。線粒體也參與細胞凋亡時的鈣離子信號轉導。
除了合成ATP為細胞提供能量等主要功能外,線粒體還承擔了許多其他生理功能。
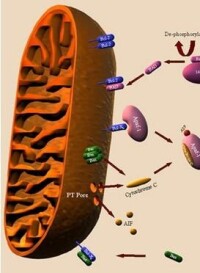
·調節膜電位並控制細胞程序性死亡:當線粒體內膜與外膜接觸位點處生成了由己糖激酶(細胞質基質蛋白)、外周苯並二氮受體和電壓依賴陰離子通道(線粒體外膜蛋白)、肌酸激酶(線粒體膜間隙蛋白)、ADP-ATP載體(線粒體內膜蛋白)和親環蛋白D(線粒體基質蛋白)等多種蛋白質組成的通透性轉變孔道(PT孔道)后,會使線粒體內膜通透性提高,引起線粒體跨膜電位的耗散,從而導致細胞凋亡。線粒體膜通透性增加也能使誘導凋亡因子(AIF)等分子釋放進入細胞質基質,破壞細胞結構。
·細胞增殖與細胞代謝的調控;
·合成膽固醇及某些血紅素。
線粒體的某些功能只有在特定的組織細胞中才能展現。例如,只有肝臟細胞中的線粒體才具有對氨氣(蛋白質代謝過程中產生的廢物)造成的毒害解毒的功能
線粒體是對各種損傷最為敏感的細胞器之一。在細胞損傷時最常見的病理改變可概括為線粒體數量、大小和結構的改變:
線粒體的平均壽命約為10天。衰亡的線粒體可通過保留的線粒體直接分裂為二予以補充。在病理狀態下,線粒體的增生實際上是對慢性非特異性細胞損傷的適應性反應或細胞功能升高的表現。例如心瓣膜病時的心肌線粒體、周圍血液循環障礙伴間歇性跛行時的骨骼肌線粒體的呈增生現象。
線粒體數量減少則見於急性細胞損傷時線粒體崩解或自溶的情況下,持續約15分鐘。慢性損傷時由於線粒體逐漸增生,故一般不見線粒體減少(甚至反而增多)。此外,線粒體的減少也是細胞未成熟和(或)去分化的表現。
細胞損傷時最常見的改變為線粒體腫大。根據線粒體的受累部位可分為基質型腫脹和嵴型腫脹二種類型,而以前者為常見。基質型腫脹時線粒體變大變圓,基質變淺、嵴變短變少甚至消失(圖1-9)。在極度腫脹時,線粒體可轉化為小空泡狀結構。此型腫脹為細胞水腫的部分改變。光學顯微鏡下所謂的濁腫細胞中所見的細顆粒即腫大的線粒體。嵴型腫較少見,此時的腫脹局限於嵴內隙,使扁平的嵴變成燒瓶狀乃至空泡狀,而基質則更顯得緻密。嵴型腫脹一般為可復性,但當膜的損傷加重時,可經過混合型而過渡為基質型。
線粒體為對損傷極為敏感的細胞器,其腫脹可由多種損傷因子引起,其中最常見的為缺氧;此外,微生物毒素、各種毒物、射線以及滲透壓改變等亦可引起。但輕度腫大有時可能為其功能升高的表現,較明顯的腫脹則恆為細胞受損的表現。但只要損傷不過重、損傷因子的作用不過長,腫脹仍可恢復。
線粒體的增大有時是器官功能負荷增加引起的適應性肥大,此時線粒體的數量也常增多,例如見於器官肥大時。反之,器官萎縮時,線粒體則縮小、變少。
線粒體嵴是能量代謝的明顯指征,但嵴的增多未必均伴有呼吸鏈酶的增加。嵴的膜和酶平行增多反映細胞的功能負荷加重,為一種適應狀態的表現;反之,如嵴的膜和酶的增多不相平行,則是胞漿適應功能障礙的表現,此時細胞功能並不升高。
在急性細胞損傷時(大多為中毒或缺氧),線粒體的嵴被破壞;慢性亞致死性細胞損傷或營養缺乏時,線粒體的蛋白合成受障,以致線粒體幾乎不再能形成新的嵴。
根據細胞損傷的種類和性質,可在線粒體基質或嵴內形成病理性包含物。這些包含物有的呈晶形或副晶形(可能由蛋白構成),如在線粒體性肌病或進行性肌營養不良時所見,有的呈無定形的電子緻密物,常見於細胞趨於壞死時,乃線粒體成分崩解的產物(脂質和蛋白質),被視為線粒體不可復性損傷的表現。線粒體損傷的另一種常見改變為髓鞘樣層狀結構的形成,這是線粒體膜損傷的結果。
衰亡或受損的線粒體,最終由細胞的自噬過程加以處理並最後被溶酶體酶所降解消化。
線粒體是直接利用氧氣製造能量的部位,90%以上吸入體內的氧氣被線粒體消耗掉。但是,氧是個“雙刃劍”,一方面生物體利用氧分子製造能量,另一方面氧分子在被利用的過程中會產生極活潑的中間體(活性氧自由基)傷害生物體造成氧毒性。生物體就是在不斷地與氧毒性進行鬥爭中求得生存和發展的,氧毒性的存在是生物體衰老的最原初的原因。線粒體利用氧分子的同時也不斷受到氧毒性的傷害,線粒體損傷超過一定限度,細胞就會衰老死亡。生物體總是不斷有新的細胞取代衰老的細胞以維持生命的延續,這就是細胞的新陳代謝。
保持線粒體完好無損就是保持了細胞的活力,擁有健康的肌膚細胞就是留住了青春。這個道理只有細細的品味,才能從中受益。皮膚細胞的新陳代謝就是自然的皮膚更新過程,新陳代謝旺盛細胞更新速率就快,總有一些新生的細胞出現在臉上,才有美麗青春的魅力。
人類線粒體出現問題會導致線粒體病,線粒體病是一大類遺傳代謝病,線粒體病主要包括:母系遺傳Leigh綜合征,線粒體肌病,多系統疾病、心肌病、進行性眼外肌麻痹,Leer遺傳性視神經病,線粒體肌病,肌病,糖尿病和耳聾、共濟失調舞蹈病、細胞外基質慢性遊走性紅斑、進行性眼外肌麻痹、肌紅蛋白尿電機神經元疾病,鐵粒幼細胞貧血、MERRF-線粒體肌病、肌陣攣(癲癇)、線粒體腦肌病、、MERRF、線粒體肌病、共濟失調併發色素性視網膜炎、,家族性雙側紋狀體壞死、共濟失調併發色素性視網膜炎、家族性雙側紋狀體壞死、骨骼肌溶解症、嬰兒猝死綜合征等等疾病。
線粒體病遺傳方式複雜,導致疾病的原因主要由核基因和線粒體基因造成,臨床表現複雜,確切病因的診斷十分困難,往往通過大分子酶學活性檢測分析並結合遺傳學基因分析的雙重手段確定病因。
線粒體基因組屬於母系遺傳,為了避免新生兒缺陷,產前媽媽的線粒體基因組分析十分必要。
(protein targeting)
遊離核糖體合成的蛋白質在細胞內的定位是由前體蛋白本身具有的引導信號決定的。不同類型的引導信號可以引導蛋白質定位到特定的細胞器,如線粒體、葉綠體、細胞核和過氧化物酶體等。這些蛋白質在遊離核糖體上合成釋放之後需要自己尋找目的地,因此稱為蛋白質尋靶。
(post-translational translocation)
遊離核糖體上合成的蛋白質必須等蛋白質完全合成並釋放到胞質溶膠后才能被轉運,所以將這種轉運方式稱為翻譯後轉運。通過這種方式轉運的蛋白質包 括線粒體、葉綠體和細胞核的部分蛋白,以及過氧化物酶體的全部蛋白等。在遊離核糖體上合成的蛋白質中有相當一部分直接存在於胞質溶膠中,包括細胞骨架蛋白、各種反應體系的酶或蛋白等。
(protein sorting)
主要是指膜結合核糖體上合成的蛋白質,通過信號肽,在翻譯的同時進入內質網,然後經過各種加工和修飾,使不同去向的蛋白質帶上不同的標記,最後經過高爾基體反面網路進行分選,包裝到不同類型的小泡,並運送到目的地,包括內質網、高爾基體、溶酶體、細胞質膜、細胞外和核膜等。
廣義的蛋白質分選也包括在遊離核糖體上合成的蛋白質的定位。
(co-translational translocation)
膜結合核糖體上合成的蛋白質,在它們進行翻譯的同時就開始了轉運,主要是通過定位信號,一邊翻譯,一邊進入內質網,然後再進行進一步的加工和轉移。由於這種轉運定位是在蛋白質翻譯的同時進行的,故稱為共翻譯轉運。在膜結合核糖體上合成的蛋白質通過信號肽,經過連續的膜 系統轉運分選才能到達最終的目的地,這一過程又稱為蛋白質分選,或蛋白質運輸(protein trafficking)。
(free ribosomes)
在蛋白質合成的全過程中,結合有mRNA的核糖體都是遊離存在的(實際上是與細胞骨架結合在一起的),不與內質網結合。這種核糖體之所以不與內質網結合,是因為被合成的蛋白質中沒有特定的信號,與核糖體無關。
(membrane-bound ribosomes)
結合有mRNA並進行蛋白質合成的核糖體在合成蛋白質的初始階段處於遊離狀態,但是隨著肽鏈的合成,核糖體被引導到內質網上與內質網結合在一起,這種核糖體稱為膜結合核糖體。
這種核糖體與內質網的結合是由合成的新生肽N端的信號序列決定的,而與核糖體自身無關。
(leading peptide)
又稱轉運肽(transit peptide)或導向序列(targeting sequence),它是遊離核糖體上合成的蛋白質的N-端信號。
導肽是新生蛋白N-端一段大約20~80個氨基酸的肽鏈,通常帶正電荷的鹼性氨基酸(特別是精氨酸和賴氨酸)含量較為豐富,如果它們被不帶電荷的氨基酸取代就不起引導作用,說明這些氨基酸對於蛋白質的定位具有重要作用。這些氨基酸分散於不帶電荷的氨基酸序列之間。轉運肽序列中 不含有或基本不含有帶負電荷的酸性氨基酸,並且有形成兩性α螺旋的傾向。轉運肽的這種特徵性的結構有利於穿過線粒體的雙層膜。不同的轉運肽之間沒有同源 性,說明導肽的序列與識別的特異性有關,而與二級或高級結構無太大關係。
導肽運送蛋白質時具有以下特點:①需要受體; ②消耗ATP; ③需要分子伴侶; ④要電化學梯度驅動; ⑤要信號肽酶切除信號肽; ⑥通過接觸點進入;⑦非摺疊形式運輸。
(oxidation)
葡萄糖(或糖原)在正常有氧的條件下,經氧化產生CO2 和水,這個總過程稱作糖的有氧氧化,又稱細胞氧化或生物氧化。整個過程分為三個階段: ①糖氧化成丙酮酸。葡萄糖進入細胞后經過一系列酶的催化反應,最後生成丙酮酸的過程,此過程在細胞質中進行,並且是不耗能的過程;②丙酮酸進入線粒體,在基質中脫羧生成乙醯CoA; ③乙醯CoA進入三羧酸循環,徹底氧化。
(glycolysis)
葡萄糖在無氧條件下,生成丙酮酸的過程。此過程在細胞質中進行,並且是不耗氧的過程。
三羧酸循環(citric acid cycle)
由乙醯CoA和草醯乙酸縮合成有三個羧基的檸檬酸,檸檬酸經一系列反應,一再氧化脫羧,經α酮戊二酸、琥珀酸,再降解成草醯乙酸。而參與這一循環的丙酮酸的三個碳原子,每循環一次,僅用去一分子乙醯基中的二碳單位,最後生成兩分子的CO2,並釋放出大量的能量。
電子載體(electron carriers)
在電子傳遞過程中與釋放的電子結合併將電子傳遞下去的物質稱為電子載體。參與傳遞的電子載體有四種∶黃素蛋白、細胞色素、鐵硫蛋白和輔酶Q,在這四類電子載體中,除了輔酶Q以外,接受和提供電子的氧化還原中心都是與蛋白相連的輔基。
黃素蛋白(flavoproteins)
黃素蛋白是由一條多肽結合1個輔基組成的酶類,結合的輔基可以是FAD或FMN,它們是維生素B2的衍生物,每個輔基能夠接受和提供兩個質子和電子。線粒體中的黃素蛋白主要是電子傳遞鏈中NADH脫氫酶和TCA循環中的琥珀酸脫氫酶。
細胞色素(cytochromes)
細胞色素是含有血紅素輔基的一類蛋白質。血紅素基團是由卟啉環結合一個鐵原子(鐵原子位於環的中央)構成的。與NAD+和FAD不同,在氧化還原過程中,血紅素基團的鐵原子可以傳遞單個的電子而不必成對傳遞。血紅素中的鐵通過Fe3+和 Fe2+兩種狀態的變化傳遞電子。在還原反應時,鐵原子由Fe3+狀態轉變成Fe2+狀態;在氧化反應中,鐵由Fe2+轉變成Fe3+。電子傳遞鏈中至少有五種類型的細胞色素∶a、a3、b、c和c1,它們間的差異在於血紅素基團中取代基和蛋白質氨基酸序列的不同。
鐵硫蛋白(iron-sulfur proteins,Fe/S protein)
鐵硫蛋白是含鐵的蛋白質,也是細胞色素類蛋白。在鐵硫蛋白分子的中央結合的不是血紅素而是鐵和硫,稱為鐵-硫中心(iron-sulfur centers)。最常見的是在蛋白質的中央含有四個原子,其中兩個是鐵,另兩個是硫,稱為[2Fe-2S],或在蛋白質的中央含有八個原子,其中四個是 鐵,另四個是硫,稱為[4Fe-4S],並且通過硫與蛋白質的半胱氨酸殘基相連。在鐵硫蛋白中儘管有多個鐵原子的存在,但整個複合物一次只能接受一個電子 以及傳遞一個電子,並且也是靠Fe3+ Fe2+狀態的循環變化傳遞電子。
醌(uniquinone UQ)或輔酶Q(coenzyme Q)
輔酶Q是一種脂溶性的分子,含有長長的疏水鏈,由五碳類戊二醇構成。如同黃素蛋白,每一個醌能夠接受和提供兩個電子和質子,部分還原的稱為半醌,完全還原的稱為全醌(UQH2)。
氧還電位(oxidation-reduction potentials,redox potentials)
由於不同的還原劑具有不同的電子傳遞電位,而氧化與還原又是偶聯的,如NAD+和NADH.它們的差別主要是電子數量不同,所以二者間就有一個 電位差,即氧還電位。構成氧化還原的成對離子或分子,稱為氧化還原對,或氧還對(redox pair)。氧還電位在標準條件下測定,即得標準氧化還原電位(standard oxidation reduction potentials,E0')。標準氧化還原電位的值越小,提供電子的能力越強。所謂標準條件是指1M反應濃度、25℃、pH 7.0和1個大氣壓,測得的氧還電位用伏特(V)表示。
呼吸鏈(respiratory chain)
又稱電子傳遞鏈,是線粒體內膜上一組酶的複合體。其功能是進行電子傳遞,H+的傳遞及氧的利用,最後產生H2O和ATP。
複合物I( complex I)
複合物I又稱NADH 脫氫酶(NADH dehydrogenase)或NADH-CoQ 還原酶複合物,功能是催化一對電子從NADH傳遞給CoQ,它是線粒體內膜中最大的蛋白複合物,是跨膜蛋白,也是呼吸鏈中了解最少的複合物。哺乳動物的複合物Ⅰ含有42 種不同的亞基,總相對分子質量差不多有1000kDa。其中有7個亞基都是疏水的跨膜蛋白,由線粒體基因編碼。複合物Ⅰ含有黃素蛋白(FMN)和至少6個 鐵硫中心(iron-sulfur centers)。一對電子從複合物Ⅰ傳遞時伴隨著4個質子被傳遞到膜間隙。
複合物Ⅱ(complex Ⅱ)
複合物Ⅱ又稱為琥珀酸脫氫酶(succinate dehydrogenase)或琥珀酸-CoQ 酶複合物,功能是催化電子從琥珀酸傳遞給輔酶Q,由幾個不同的多肽組成,其中有兩個多肽組成琥珀酸脫氫酶,並且是膜結合蛋白。複合物Ⅱ參與的是低能電子傳 遞途徑,將琥珀酸的電子經FAD傳給CoQ。複合物Ⅱ傳遞電子時不伴隨氫的傳遞。
複合物Ⅲ(complex Ⅲ)
複合物Ⅲ又稱CoQH2-細胞色素c 還原酶複合物,總相對分子質量為250kDa。含1個細胞色素c1、1個細胞色素b(有兩個血紅素基團)、1個鐵硫蛋白,其中細胞色素b由線粒體基因編碼。複合物Ⅲ催化電子從輔酶Q向細胞色素c傳遞,並且每傳遞一對電子,同時傳遞4個H+到膜間隙。
複合物Ⅳ(complex Ⅳ)
複合物Ⅳ又稱細胞色素c氧化酶(cytochrome c oxidase)。總相對分子質量為200kDa。複合物Ⅳ是以二聚體的形式存在,它的亞基Ⅰ和Ⅱ都含有4個氧化還原中心(redox-active centers)和兩個a型細胞色素(含有1個a、1個a3)和兩個Cu。主要功能是將電子從細胞色素c傳遞給O2 分子,生成H2O∶4cyt c2+ + O2 + 4H+ → 4cyt c3+ + 2H2O。每傳遞一對電子,要從線粒體基質中攝取4個質子,其中兩個質子用於水的形成,另兩個質子被跨膜轉運到膜間隙。
電化學梯度(electrochemical gradient)
質子跨過內膜向膜間隙的轉運也是一個生電作用(electrogenesis),即電壓生成的過程。因為質子跨膜轉運使得膜間隙積累了大量的質 子,建立了質子梯度。由於膜間隙質子梯度的建立,使內膜兩側發生兩個顯著的變化∶線粒體膜間隙產生大量的正電荷,而線粒體基質產生大量的負電荷,使內膜兩側形成電位差;第二是兩側氫離子濃度的不同因而產 生pH梯度(ΔpH),這兩種梯度合稱為電化學梯度(electrochemical gradient)。線粒體內膜兩側電化學梯度的建立,能夠形成質子運動力(proton-motive force,Δp),只要有合適的條件即可轉變成化學能儲存起來。
ATP合酶(ATP synthase)
ATP或稱F0F1 複合物(F0F1 complexes),該酶在分離狀態下具有ATP水解酶的活性,在結合狀態下具有ATP合酶的活性,屬F型ATPase。除了線粒體中有ATP合酶外,植物葉綠體的類囊體和好氧細菌都有ATP合酶的同源物,ATP合酶的分子組成和主要特點是:
頭部:頭部即F1,細菌和線粒體ATP合酶的F1都是水溶性的蛋白,結構相似,由5種多肽(α、β、γ、δ和ε)組成的九聚體(α3β3γδε),α亞基和β亞基構成一種球形的排列,頭部含有三個催化ATP合成的位點,每個β亞基含有一個。
柄部∶由F1的γ亞基和ε亞基構成柄部,將頭部與基部連接起來。γ亞基穿過頭部作為頭部旋轉的軸。構成基部的亞基b向外延伸成為柄部的構成部分。
基部∶基部稱為F0,是由鑲嵌在線粒體內膜的疏水性蛋白質所組成,由3種不同的亞基組成的十五聚體(1a:2b:12c)。其中c亞基在膜中形成物質運動的環,b亞基穿過柄部將F1固定; a亞基是質子運輸通道,允許質子跨膜運輸。
氧化磷酸化(oxidative phosphorylation)
在活細胞中伴隨著呼吸鏈的氧化過程所發生的能量轉換和ATP的形成,稱為氧化磷酸化。
化學滲透假說(chemiosmotic coupling hypothesis)
英國生物化學家P.Mitchell 於1961年提出的解釋釋氧化磷酸化偶聯機理的假說。該學說認為:在電子傳遞過程中,伴隨著質子從線粒體內膜的裡層向外層轉移,形成跨膜的氫離子梯度,這種勢能驅動了氧化磷酸化反應(提供了動力),合成了ATP。這一學說具有大量的實驗證明,得到公認並獲得了1978年諾貝爾獎。化學滲透學說可以很好地說明線粒體內膜中電子傳遞、質子電化學梯度建 立、ADP磷酸化的關係。
內共生學說(endosymbiont hypothesis)
關於線粒體起源的一種學說。認為線粒體來源於細菌,即細菌被真核生物吞噬后,在長期的共生過程中,通過演變,形成了線粒體。該學說認為:線粒體 祖先原線粒體(一種可進行三羧酸循環和電子傳遞的革蘭氏陰性菌)被原始真核生物吞噬后與宿主間形成共生關係。在共生關係中,對共生體和宿主都有好處:原線 粒體可從宿主處獲得更多的營養,而宿主可借用原線粒體具有的氧化分解功能獲得更多的能量。
非內共生學說
又稱細胞內分化學說。認為線粒體的發生是質膜內陷的結果。有幾種模型,其中Uzzell的模型認為:在進化的最初階段,原核細胞基因組進行復 制,並不伴有細胞分裂,而是在基因組附近的質膜內陷形成雙層膜,將分離的基因組包圍在這些雙層膜的結構中,從而形成結構可能相似的原始的細胞核和線粒體、葉綠體等細胞器。後來在進化的過程中,增強分化,核膜失去了呼吸和光合作用,線粒體成了細胞的呼吸器官,這一學說解釋了核膜的演化漸進的過程。
目前有兩種不同的假說,即內共生假說和分化假說。
線粒體來源於被原始的前真核生物吞噬的好氧性細菌(該細菌有可能是革蘭氏陰細菌);這種細菌和前真核生物共生,在長期的共生過程中演化成了線粒體。
證據:1 它的基因組大小,形態,結構與細菌相似。都由裸露、環狀雙鏈DNA構成,不含組蛋白。
2有自己完整的蛋白質合成系統,能合成一部分自己需要的蛋白質。
3內外膜結構,成分差異大,外膜與細胞內膜相似,內膜與細菌質膜相似
4與細菌一樣能用二分裂繁殖自我
不足之處:
從進化角度,如何解釋在代謝上明顯佔優勢的共生體反而
將大量的遺傳信息轉移到宿主細胞中?
◆不能解釋細胞核是如何進化來的,即原核細胞如何演化為
真核細胞?
核生物基因組中不存在內含子,如果同意內共生起源
學說的觀點,那麼線粒體和葉綠體基因組中的內含子
從何發生?
線粒體在進化過程中的發生是由於質膜的內陷,再分化后形成的。
主要內容:真核細胞的前身是一個進化上比較高等的好氧細菌。
◆成功之處:解釋了真核細胞核被膜的形成與演化的漸進過程。
◆不足之處:
◆實驗證據不多
◆無法解釋為何線粒體、葉綠體與細菌在DNA分
子結構和蛋白質合成性能上有那麼多相似之處
◆對線粒體和葉綠體的DNA酶、RNA酶和核糖體
的來源也很難解釋。
◆真核細胞的細胞核能否起源於細菌的核區?
染色觀察

顯微鏡下
線粒體用鐵蘇木素染色呈黑色,分佈於核周圍的細胞質中,線粒體在高倍鏡下呈粒狀、線狀或短棒狀,或直或曲,輪廓鮮明。
胰髒的分泌細胞呈錐形,核大而圓,位於細胞中央,細胞遊離端聚集有許多大而圓的黑色顆粒為分泌顆粒。
提取觀察
線粒體是細胞中重要的細胞器,存在於絕大多數生活細胞中,它的主要功能是提供細胞內各種物質代謝所需要的能量。正由於這樣,對線粒體膜,呼吸鏈酶及線粒體DNA等成分的結構,功能以及物理化學性質的研究已經成為細胞生物學研究中的重要課題,所以提取線粒體的技術已經成為線粒體研究中必不可少的手段,線粒體大量存在於代謝旺盛的細胞中,如動物的心肌,肝,腎等器官和組織的細胞中,大量置備線粒體就是從這些器官組織中提取,當所用樣品較少時(如電鏡和光鏡的觀察)可採用從組織培養細胞中提取,本實驗就是介紹兩種材料製備用於光鏡觀察的線粒體。
一、目的與要求
了解提取線粒體的基本原理及其過程,通過光學顯微鏡的觀察了解體外分離的線粒體的一般形態
二、基本原理
線粒體具有完整的結構,一定的大小和質量,低溫條件下在等滲液中破碎細胞,差速離心后,獲得線粒體。經活性染料健那綠Janus green B染色,線粒體呈淺藍色。
三、實驗內容
1.線粒體的分離提取 2. 鼠肝的勻漿製備 3. 線粒體的活體染色
四、實驗步驟
(一)動物組織線粒體的分離,提取與觀察
顯微鏡檢查:將1%Janus green B溶液按1:1比例加入線粒體懸液中,在室溫或水浴中染15~20分鐘,用吸管吸取一滴線粒體懸液,滴於載玻片上,加蓋玻片后,放顯微鏡下進行觀察,線粒體為藍綠色圓形顆粒。
2.組織培養細胞的線粒體的提取與觀察
操作中應該注意的問題
1. 整個操作過程為保證線粒體的完整,應盡量使操作時的環境如溫度(0—4℃),pH (7.0左右)保持恆定,同時儘可能短操作時間。
2. 組培細胞消化時要特別小心,防止損失或反覆。(損失指細胞脫落到消化液中)。
3. 勻漿時,所用的介質一定是等滲緩衝液,常用的有0.25 mol/L蔗糖溶液或生理鹽水代替Hank’s液
4. 勻漿次數依照勻漿器的鬆緊而定,次數過少,細胞破損不完全,就會影響線粒體產量。
5. 所以取2/3上清夜用來製備線粒體是為防止細胞碎片過多影響觀察。
6. 整個分離過程,一般最好在30—60分鐘內完成,不宜過長。光合作用中放大太陽能那無聲的轟鳴。
2020年12月,科學家對線粒體的嵴有了新的發現,先進的超解析度顯微技術顯示嵴是獨立的生物能量單位,具有高度的動態性並可以在秒尺度上重構。這些進展,加上對關鍵分子的機制和結構研究,從根本上改變了我們對線粒體的認識。德國杜塞爾多夫大學的阿倫·庫馬爾·孔達迪等研究人員總結了這些最新發現並討論了其功能意義。