膠原纖維
膠原纖維
膠原纖維是主要含有膠原蛋白,氨基酸有甘氨酸、脯氨和羥脯氨酸等的纖維組合物。膠原纖維是三種纖維中分佈最廣泛,含量最多的一種纖維。廣泛分佈於各臟器內,在皮膚、鞏膜和肌腱最為豐富。膠原纖維染色主要用於和肌纖維的鑒別。
膠原纖維是真皮中的主要成分,占真皮全部纖維質量的95%-98%.新鮮的膠原纖維呈白色,故又稱白纖維。在HE染色標本中,膠原纖維被染成粉紅色,較粗大,直徑0.5-20um,成束分佈,排列緊密,並交織成網。
膠原是唯一含羥脯氨酸較多的蛋白質,因此,測定羥脯氨酸的量能確定組織中膠原的含量。膠原蛋白佔全身蛋白質的30%。聚合成膠原的微原纖維的蛋白質分子稱為原膠原分子。
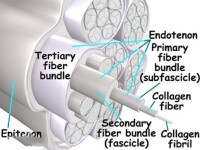
膠原纖維
膠原纖維:染成粉紅色,束狀,其中的原纖維大多看不清;
兒童時期,骨骼的膠元纖維占的比重較大,成骨細胞製造骨質十分活躍。因此,兒童的骨骼彈性大,不易折斷。
Ⅰ型膠原的原纖維平行排列成較粗大的束,成為光鏡下可見的膠原纖維,抗張強度超過鋼筋。其三股螺旋由二條α1(Ⅰ)鏈及一條α2(Ⅰ)鏈構成。每條α鏈約含1050個氨基酸殘基,由重複的Gly-X-Y序列構成。X常為Pro(脯氨酸),Y常為羥脯氨酸或羥賴氨酸殘基。重複的Gly-X-Y序列使α鏈捲曲為左手螺旋,每圈含3個氨基酸殘基。三股這樣的螺旋再相互盤繞成右手超螺旋,即原膠原。
原膠原分子間通過側向共價交聯,相互呈階梯式有序排列聚合成直徑50~200nm、長150nm至數微米的原纖維,在電鏡下可見間隔67nm的橫紋。膠原原纖維中的交聯鍵是由側向相鄰的賴氨酸或羥賴氨酸殘基氧化后所產生的兩個醛基間進行縮合而形成的。
原膠原共價交聯后成為具有抗張強度的不溶性膠原。胚胎及新生兒的膠原因缺乏分子間的交聯而易於抽提。隨年齡增長,交聯日益增多,皮膚、血管及各種組織變得僵硬,成為老化的一個重要特徵。
人α1(Ⅰ)鏈的基因含51個外顯子,因而基因轉錄后的拼接十分複雜。翻譯出的肽鏈稱為前α鏈,其兩端各具有一段不含Gly-X-Y序列的前肽。三條前α鏈的C端前肽借二硫鍵形成鏈間交聯,使三條前α鏈“對齊”排列。然後從C端向N端形成三股螺旋結構。前肽部分則呈非螺旋捲曲。帶有前肽的三股螺旋膠原分子稱為前膠原(procollagen)。膠原變性后不能自然復性重新形成三股螺旋結構,原因是成熟膠原分子的肽鏈不含前肽,故而不能再進行“對齊”排列。
探索一個簡要的膠原提純方法,比較提取不同來源的膠原蛋白的物理化學特性,利用影像法探討膠原纖維體外生長聚合三維構建過程和特徵,為生物醫學工程的生物材料設計和組織工程替代治療提供基礎。方法:利用乙酸法和酶的降解法提取豬腳關節韌帶、大鼠尾的膠原蛋白,用光學顯微鏡定量化分析纖維聚集動力學以及結構特性,包括纖維密度、方向性融合。結果:組織和細胞中Ⅰ型膠原蛋白單分子是120kD,Ⅰ型膠原α1(Ⅰ)以及α2鏈表達在120、116kD,Ⅰ型膠原蛋白基質行成的膠原纖維狀。結論:應用該修飾方法可提出並純化到純的膠原蛋白。第一次報道膠原基質成分在體外可形成三維結構並用黑白視野觀察纖維形成特徵;陽離子鉀、鈉、溫度及pH影響纖維的強度和膠原的集結時間。
膠原纖維在HE染色法被染成粉紅色,除此之外,它還可以用一些陰離子的染料來進行染色,如用淡綠可把它們染為綠色,用甲苯胺藍可將其染為藍色,在網狀纖維染色中,如不加以處理,它又可被染為棕黃色。常用的特殊染色法有Van Gieson.Masson和Mallary等方法。在免疫細胞化學染色中,膠原纖維由於含的負電荷過多,常導致某些非特異性的染色,應特別注意。
(一).Van Gieson(V.G)染色法
I. 試劑的配製:
weigert氏蘇木素
A液:蘇木素 1g (haematoxylin)
無水酒精 100ml
B液: 30%三氯化鐵 4ml (ferric chloride)
蒸餾水 95ml
鹽酸 1ml
II.Van Gieson氏液
A液:酸性品紅 1g(acid fuchsin)
蒸餾水 100ml
B液:苦味酸飽和水溶液,(1.22%)(picric acid)
注意事項:
1、Weigert氏蘇木素臨用前取A液和B液等份混合,幾個小時內用完,最長不得超過一天。
2、蘇木素配后經二十多天才能成熟,必須提前配製。
3、該液能抵抗弱酸性染液,對已著染的細胞核在酸性染液的作用,不易被脫去顏色,如果不特別深染,則無須分化。
4、Van Gieson氏液取B液9ml,加入A液1ml,即可使用。
操作方法:(後面的各種方法,如沒特別說明,都在室溫下進行)
1、切片脫蠟至水,
2、用Weigert氏蘇木素染20min,
3、水洗,必要時可分化,
4、流水沖洗10min,
5、染Van Gieson氏液1min,
6、用95%酒精快速分化,
7、無水酒精脫水,二甲苯透明,封固。
結果:
注意事項:
1、該法染完的切片,較易褪色如需照相,應儘早完成。
2、蘇木素染液如為棕色或沉澱,應將其拋棄。
3、分化用的酒精,應使用95%以上的酒精,低濃度的酒精褪色能力強,容易將著染的紅色脫去。
4、切片也可以用天青蘭蘇木素替代Weigert氏蘇木素,染核效果基本一樣。
(二).Masson氏三色染色法:天青石藍液的配製:天青石藍(Celestin blue B) 1.25g 硫酸鐵銨(ferric ammonium sulfate)1.25g
蒸餾水 200ml
甘油(glycerin) 30ml
將前兩者溶於蒸餾水中,然後煮沸,冷卻後過濾,再加入甘油和麝香草酚。
Mayer氏蘇木素的配製蘇木素 0.1g 蒸餾水 100ml
鉀明礬(Potassium alum) 5g
檸檬酸(Citric acid) 0.1g
水合氯醛(Chloral hydrate)20mg
配製法:
將蘇木素放入蒸餾水中,用玻棒不停地攪拌直至完全溶解,再依次加入鉀明礬,檸檬酸和水合氯醛,再繼續攪拌,最後加入碘酸鈉,攪拌均勻,即可使用。
麗春紅酸性品紅液的配製:麗春紅(ponceau 2R) 0.7g
酸性品紅(acid fuchsin)0.3g
冰醋酸 1ml
蒸餾水 99ml
操作方法: 1
、切片脫蠟至水, 2、1%高錳酸鉀氧化切片5min,
3、水洗,草酸漂白1min,
4、水洗,蒸餾水洗,天青石藍染5min水洗,
5、摔去余液不用水洗,滴染Mayer氏蘇木素3-5min,
6、流水沖洗5-10min,
7、麗春紅苦味酸飽和液染5min,
8、1%醋酸水溶液洗,
9、1%磷鉬酸分化切片約5min,
10、蒸餾水洗,
11、1%淡綠或者甲苯胺藍滴染30s,
12、1%醋酸水溶液洗切片,
13、95%酒精分化,無水酒精脫水,
14、二甲苯透明,中性樹膠封固。
結果:膠原纖維呈現綠色或藍色,細胞核呈現灰黑或灰藍色,肌肉和胞質紅細胞呈現紅色。
注意事項:①Masson氏染液配完后保存時間不宜過長,如有可能,每次染色以染配為佳,如何可使著色顏色的鮮艷性。②切片在各級酒精中脫水,時間不宜過長,否則會將著染的顏色脫去。③切片保存所著染的顏色顯長為1—2年以後會隨著時間的延長而逐漸褪去,應予注意。④磷鉬酸和磷鎢酸在染色法中的作用各有不同,磷鉬酸作用於膠原纖維,磷鎢酸作用於纖維膠]質,肌膠質,神經膠質和上皮纖維等。上述兩種試劑的使用,可以促進組織有選擇的染色,它們可以減少背景和核的染色,使背景清晰。⑤ 如有可能,在組織固定時,用Zenker氏固定液固定,如此對染色效果將更好。
臨床應用: 1
、與澱粉樣物的區別:膠原纖維發生病變如壞死或透明變性時,它與澱粉樣物在HE染色時被染為粉紅色,不好區別。應用V.G染色法,能將膠原纖維染為粉紅色,而澱粉樣物將被染為黃色。 2、應用與間胚葉來源腫瘤的區別:
如纖維瘤(肉瘤),平滑肌、橫紋肌瘤(肉瘤),神經纖維瘤(肉瘤)、惡性纖維組織細胞瘤等,由於都含有大量的纖維,HE染色均為紅色。應用Masson氏染色法,可將膠原纖維染色藍色或綠色,肌源性組織被染為紅色。
3、應用與其他慢性炎症的區別。
如慢性闌尾炎,疤痕癒合時,纖維愈復病灶可被染為鮮紅色或藍綠色,SARS病患者癒合後有的肺部可出現疤痕,粘連,此時可顯示藍色或綠色。
可用於鑒定肝硬化及創傷組織的修復程度。肝硬化時的肝組織有許多不同大小的假小葉,用上述方法顯示時,可顯示出不同的組織結構。V.G法可將包繞假小葉的膠原纖維染成紅色,膽汗呈綠色。
小結
膠原纖維在上述的兩種方法中著染不同的顏色,如V.G著染紅色,Masson氏著染藍色或綠色。這主要取決於染料對組織的滲透、吸附、沉澱和反應,而染料分子量的大小是關鍵,分子量小的分子移動迅速,行動快,對組織的滲透性較強,能穿透較為緻密的組織。分子量大的染料分子移動較遲緩,滲透力較弱,可作用於組織強求構較疏鬆的組織,染色時間可適當延長。
在相關的染料中,分子量從小到大依次排列是:苦味酸(黃色):229.11;桔黃G(黃色):452;麗春紅(紅色):480.42;酸性品紅(紅色):585.53;苯胺藍(藍色):737.72;亮綠(綠色):792.72;甲基藍(藍色)>99。
染色是一個較為複雜的化學反應和物理作用的雙重過程,在應用這些方法時,根據不同情況,選擇不同的方法,認真地操作,方能獲得最佳的效果。
