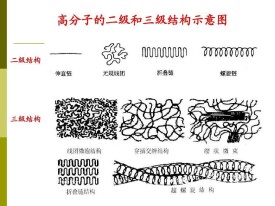
三級結構
三級結構
蛋白質的三級結構是指整條肽鏈中全部氨基酸殘基的相對空間位置,即整條肽鏈的三維空間結構。三級結構的形成和穩定主要靠疏水鍵、鹽鍵、二硫鍵、氫鍵等。許多(並非所有)有生物活性的蛋白質由兩條或多條具有三級結構的肽鏈構成,每條肽鏈被稱為一個亞基,通過非共價鍵維繫亞基與亞基之間的空間位置關係)這就是蛋白質的四級結構。各亞基之間的結合力主要是疏水鍵,氫鍵和離子鍵也參與維持四級結構。
三級結構是由一個已經具有了某些a-螺旋和/或b摺疊區的多肽鏈摺疊成一個緊密包裹的、幾乎成球形的空間結構,或稱為天然構象。
三級結構的一個重要特點是在一級結構上離得遠的氨基酸殘基在三級結構中可以靠的很近,它們的側鏈可以發生相互作用。二級結構是靠骨架中的醯胺和羰基之間形成的氫鍵維持穩定的,三級結構主要是靠氨基酸殘基側鏈之間的非共價相互作用(主要是疏水作用)維持穩定的,此外二硫鍵也是穩定三級結構的力。在一個蛋白質的三級結構中,二級結構區之間是通過一些片段連接的。
肌紅蛋白(myoglobin)(下圖左)是第一個被確定的具有三級結構的蛋白質,肌紅蛋白和後面要討論的血紅蛋白的主要生物學功能是結合氧並能使氧很容易地在肌肉內擴散。肌紅蛋白是一個相對比較小的蛋白,是由153個氨基酸殘基組成的一條多肽鏈組成的,含有一個血紅素輔基(heme prosthetic group)。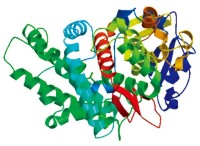

三級結構
上左圖表明,肌紅蛋白的三級結構是由一簇八個a-螺旋組成的,螺旋之間通過一些片段連接。肌紅蛋白中的四分之三氨基酸殘基都處於a-螺旋中。儘管肌紅蛋白中的高螺旋含量不是球蛋白結構中的普遍現象,但肌紅蛋白的一些結構還是給出了球蛋白的典型結構特徵。肌紅蛋白的內部幾乎都是由疏水氨基酸殘基組成的,特別是一些疏水性強的氨基酸,如纈氨酸、亮氨酸、異亮氨酸、苯丙氨酸和蛋氨酸。而表面既含有親水的氨基酸殘基,也含有疏水的氨基酸殘基,通常水分子被排除在球蛋白內部,大多數可離子化的殘基都位於表面。血紅素輔基處於一個由蛋白部分形成的疏水的、象個籠子似的裂隙內,血紅素中的鐵原子是氧結合部位。無氧的肌紅蛋白稱之脫氧肌紅蛋白,而載氧的分子稱之氧合肌紅蛋白,可逆結合氧的過程稱之氧合作用。
胡鋼 陳敏 白楊 夏春 李景德 張日清 曹萬強 劉進元 羅軍 羅毅
《生物化學與生物物理》 《自然科學進展》 《國外醫學分子生物》 《高電壓技術》 《排灌機械》《生命的化學》 《中國生物工程雜誌》