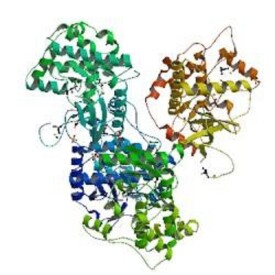
MAPK
能被細胞外刺激激活的蛋白激酶
絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)是一組能被不同的細胞外刺激,如細胞因子、神經遞質、激素、細胞應激及細胞黏附等激活的絲氨酸-蘇氨酸蛋白激酶。由於MAPK是培養細胞在受到生長因子等絲裂原刺激時被激活而被鑒定的,因而得名。所有的真核細胞都能表達MAPK。
MAPK通路的基本組成是一種從酵母到人類都保守的三級激酶模式,包括MAPK激酶激酶(MAP kinase kinase kinase,MKKK)、MAPK激酶(MAP kinase kinase,MKK)和MAPK,這三種激酶能依次激活,共同調節著細胞的生長、分化、對環境的應激適應、炎症反應等多種重要的細胞生理/病理過程。
MKKK的4個亞族已得到鑒定,其中Raf亞族研究的最為透徹,包括B-Raf、A-Raf、Raf1。MEKK亞族由4種MEKK(MEKK1~MEKK4)構成。ASK1和Tpl2組成了MKKK的第三個亞族。第四個亞族與上述三個有較大不同,它包括MST(mammalian sterile 20-like)、SPRK、MUK(MAPK upstream kinase)、TAK1,以及相關程度最小的MOS(molony sarcoma oncoprotein)。
對於MKK來說,MEK1與MEK2密切相關,而MKK3則與MKK6密切相關。
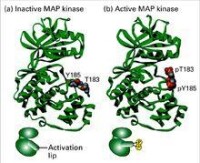
MAPK雙磷酸化
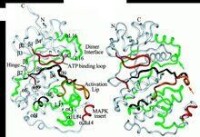
ATP結合位點示意圖
之間由一個交叉區連接在一起。氨基酸結構域主要由β摺疊組成,而羧基端結構域則主要為α螺旋,兩個結構與交界處形成一個裂隙,為ATP結合位點。
大體結構:
p38與ERK2具有約40%序列同源性。將p38和ERK2的兩個結構域同時重疊在一起時,其根均平方(root mean square ,RMS)偏離為0.17nm。JNK與ERK2和p38的同源性分別為40%和51%,其總體結構也與ERK2和p38非常相似。將ERK2和p38的羧基端結構域與JNK的羧基端結構域重疊式,兩者較JNK3的羧基端結構域分別旋轉了2.5°和4°。將ERK2的氨基酸和羧基端結構域與JNK3的對應結構域重疊時,其RMS偏離分別為0.115nm和0.158nm。
底物結合口袋的結構特徵:
在所有MAPK中,形成底物結合口袋的氨基酸殘基都是相當保守的。在未受到刺激時,ERK2的底物結合口袋被Arg佔據;當ERK2被磷酸化后,Arg轉離原來的位置,從而暴露出底物結合口袋來進行底物的結合。p38中,該位點活化機制尚不清楚。
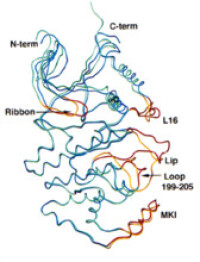
MAPK