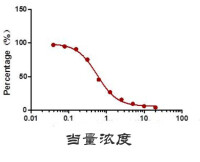
當量濃度
用於表示酸溶液質量的數值
當量濃度,即1L水溶液中溶解的溶質用氫的當量除摩爾質量,常用於表示酸溶液的質量,用符號N表示。當量濃度過去用得很多,現在基本不用了。一當量就是得失一個電子的意思。如果是鹽酸,放出一個氫離子,則當量濃度和摩爾濃度是一樣的;如果是硫酸,則一當量濃度等於二分之一的摩爾濃度。當量濃度=溶質的克當量數/溶液體積(升)。
當量濃度(N) :溶液的濃度用1升溶液中所含溶質的克當量數來表示的叫當量濃度,用符號N表示。(英文:normality)
當量濃度過去用得很多,基本不用了。
當量濃度的定義是1L水溶液中溶解的溶質用氫的當量除摩爾質量,常用於表示酸溶液的質量。
Normality is defined as the number of equivalents per liter of solution, where definition of an equivalent depends on the reaction taking place in the solution. For an acid-base reaction, the equivalent is the mass of acid or base that can furnish or accept exactly 1 mole of proton(H+ ions).
當量濃度
溶液的濃度用1升溶液中所含溶質的克當量數(gram-equivalent number)來表示的叫當量濃度,用N表示。
當量濃度=溶質的克當量數/溶液體積(升)
克當量數=質量/克當量
克當量(gram-equivalent weight)實際上是指物質的基本摩爾單元的摩爾質量。
當量=原子量/化合價,若原子量採用克原子量時,則當量就成為克當量。
克原子量就是現在常說的原子量。
(1)對於元素,當量=原子量/化合價:鈉的當量;鐵的當量;氧的當量是8;氫的是1。
(4)鹽的當量=鹽的分子量/鹽分子中金屬原子數×金屬價數:如果是氧化物或是還原 物就看能得失的電子數,比如說1mol/L的的當量濃度就應該是(每個重鉻酸鉀分子中有兩個鉻離子,每個鉻離子的價態由6+到3+得到3個電子),1mol/L的的當量濃度是。如果是鹽類,就看能與酸 或鹼結合所要的或數量,比如說的就是,是1。
當量濃度(N) 溶液的濃度用1升溶液中所含溶質的克當量數來表示的叫當量濃度,用符號N表示。
例如,1升濃鹽酸中含12.0克當量的鹽酸(HCl),則濃度為12.0N。
當量濃度=溶質的克當量數/溶液體積(升)
mol/L叫摩爾濃度,即溶液的濃度用1升溶液中所含溶質的摩爾數來表示.
例如1升濃硫酸中含18.4摩爾的硫酸,則濃度為18.4mol/L。
摩爾濃度(mol/L)=溶質摩爾數/溶液體積(升)
濃度單位的換算公式:
1)當量濃度=1000.d.質量百分濃度/E
2)質量百分濃度=當量濃度E/1000.d
3)摩爾濃度=1000.d質量百分濃度/M
4)質量百分濃度=質量-體積濃度(毫克/升)/104.d
5)質量-體積濃度(mg/L)=104質量百分濃度
5、ppm是重量的百分率, 即:
式中:E—溶質的克當量;
d—溶液的比重;
M—溶質的摩爾質量;
有效當量濃度