電池電動勢
電池內界面上電勢差的代數和
簡單的講,電池電動勢是指單位正電荷從電池的負極到正極由非靜電力所作的功。其數值也可以描述為電池內各相界面上電勢差的代數和,例如右圖所示,
電池電動勢
①電極與溶液界面電勢差:金屬浸入水中,由於極性很大的水分子與金屬表面上的離子相互吸引發生水化作用,加上運動著的水分子的不斷碰撞,減弱了電極表面一部分金屬離子與電極上其他金屬離子之間的鍵力,使極少數金屬離子離開電極表面進入附近的水層中。這樣導致金屬電極相荷負電,溶液相荷正電。由於靜電引力,進入溶液的金屬離子大部分聚集在金屬電極表面附近,阻礙了金屬離子繼續由電極向溶液轉移,而進入溶液的金屬離子仍可沉積到電極表面。這種金屬離子的相間轉移,很快就會達到平衡狀態。由於離子的熱運動,集中在電極附近的金屬離子又會向遠離電極的方向擴散。靜電引力和熱運動兩種因素綜合作用的結果,在兩相界面上形成一個雙電層。在溶液中的一層可分為緊密層和分散層兩部分。緊密層的厚度約為10cm,擴散層的厚度稍大。由緊密層和分散層形成的電極電勢,通常叫做絕對電極電勢。若液體不是純水,而是組成電極的金屬鹽溶液,金屬電極及其鹽溶液之間也會產生雙電層,由於金屬離子從溶液沉積到電極表面的速度加快,這時雙電層電勢與在純水中的情況不同。若金屬離子較容易進入溶液,則金屬電極荷負電,只是電勢數值比在純水中要大;若金屬離子不易進入溶液,則溶液中的金屬離子向電極表面的沉積速度較大而使電極金屬荷正電。總之,電極與溶液界面電勢差的符號和大小,取決於電極的金屬種類及溶液中金屬離子的濃度。
②接觸電勢差:不同金屬的電子脫出功不同,因此,不同的金屬接觸時相互滲入的電子數目不等,使兩金屬界面上也形成雙電層結構,產生的電勢差稱為接觸電勢差。其數值大小,決定於金屬的本性。
電池的電動勢不能用伏特計來測量,因為電池與伏特計相接后,便形成了通路,有電流通過,電池發生電化學變化,電極被極化,溶液濃度改變,電動勢不能保持穩定,且電池本身有內阻,伏特計所量得兩極的電位差僅是電池電動勢的一部分。利用對消法(或稱補償法)在電池無電流(或極小電流)通過時,測得的兩極間的電位差,即為該電池的電動勢。
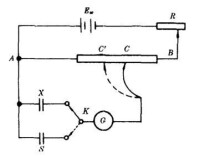
對消法測電動勢
(1)電位差計:是根據對消法測量原理設計的一種平衡式電壓測量儀器,它與標準電池、檢流計等配合,成為電壓測量中最基本的測試設備。
今天,日益發展的電子工業為電動勢以及電壓測量提供了數字電壓表等一類全新的電子測試儀器,它們具有快速、靈敏、數字化等優點。
①計算平衡常數:化學反應處於平衡態時,ΔG=0,即E=0,一個化學反應如果能夠安排成可逆電池,則它的平衡常數和ΔG°可通過測量電動勢來計算。
③電動勢與化學分析:E°已知時,通過測量電池電動勢E可求出參與反應物質的活度,這是電化學分析法中電位法和電位滴定的基礎。如參與反應的物質的濃度已知,則可求出活度係數,電池電動勢法是測電解質平均活度係數的重要方法。
電極電動勢簡介
當用導線連接原電池的兩電極,檢流計指針就會偏轉,表明在兩電極之間存在電勢差,即兩電極的電勢不同。
電極電動勢的影響因素:濃度,溶液pH,沉澱的生成,配合物的生成,弱電解質的生成等都能對電極電勢產生影響。
電極電勢數值的確定:電極電勢的絕對值無法測量,必須與標準氫電極構成電池,規定標準氫電極的電極電勢為0V,通過測量電池的電動勢,獲得該電極的電極電勢。
電極電勢符號的確定:電極電勢值可正、可負,由電位差計指針的偏轉來確定。正負值是相對於標準氫電極為零而言的。
電池電動勢簡介
是指電池正負電極之間的平衡電勢差,即在沒有電流通過時的兩電極之間的電勢差,通常用E表示。