雷酸
具有揮發性的化合物
雷酸一般為吸濕晶體或油狀液體,酸性比醋酸強,比磷酸弱,稍微比亞硝酸強一點,具有揮發性,其蒸汽有劇毒。雷酸及雷酸鹽性質不穩定,易爆炸,以前常用於炸藥。其正鹽一般溶解度在100克水中0.8g~3.25g左右。一氫鹽易溶於水,水解一般呈酸性。雷酸屬於二元酸,而非一元酸。其原因是雷酸通常以H-O-N=C=C=N-O-H的形式存在,該結構不穩定,易爆炸。
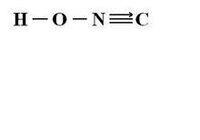
雷酸
雷酸大多數時候為雙分子結構。屬於酸性肟烯類物質。因為其雙分子結構HONC=CNOH由碳碳雙鍵連接,故有類似乙烯的加成反應性質,能使溴水退色,並生成二溴乙肟(HO-N=CBr-CBr=N-OH)。尤斯圖斯·馮·李比希在1824年首次合成了雷酸。
——關於雷酸(HONC)和氰酸(HOCN)
維勒測定了氰酸的化學成分,指出它是由碳、氮、氫、氧4種元素組成的。22歲的維勒發表了平生第二篇論文,公布了他所定的氰酸的化學成分。緊接著,維勒又製得了氰酸銀和氰酸鉀,測定了它們的化學成分。
就在維勒發表第三篇論文時,格麥林教授提醒他:“請你注意一下德國化學家李比希剛發表的論文!”那時候的李比希,才20歲。維勒趕緊查閱了李比希的論文。奇怪,李比希測定了一種“雷酸”的化學成分,竟跟氰酸差不多!氰酸跟雷酸,化學性質截然不同,氰酸很安定,雷酸很易爆炸。不同的化合物,怎麼會具有相同的成分?
於是,李比希拿來氰酸銀進行分析,發現其中含有氧化銀71%,並不象維勒所說的是77.23%。李比希發表論文,認為維勒搞錯了。維勒又重做實驗,發現李比希搞錯了,因為李比希所用的氰酸銀不純凈。維勒進一步測定,認為氰酸銀所含氧化銀應為77.5%。就這樣,維勒和李比希展開了熱烈的爭論。
1826年,李比希發表論文,說他提純了氰酸銀之後,所得結論與維勒一樣,同時也與他所測得的雷酸銀的化學成分一樣。對此,他們無法解釋:兩種顯然不同的化合物,怎麼會有相同的成分呢?他們談起了氰酸、雷酸,雷酸銀、氰酸銀。經過詳盡的討論,認為雙方都沒有錯。
1830年,柏濟力阿斯提出了一個嶄新的化學概念,叫做“同分異性”。意思是說,同樣的化學成分,可以組成性質不同的化合物。他認為,氰酸與雷酸,便屬於“同分異性”,它們的化學成分一樣,卻是性質不同的化合物。在此之前,化學界一向認為,一種化合物具有一種成分,絕沒有兩種不同化合物具有同一化學成分。
