亞硝酸
N(III)對應的含氧酸
亞硝酸是N(III)對應的含氧酸,是一種弱酸,電離平衡常數Ka=6.0E-4,只能存在於很稀的冷溶液中,溶液濃縮或加熱時,就分解成H2O和N2O3,後者又會分解成NO2和NO。用於制染料、藥物,並用作試劑。
亞硝酸僅存在於稀的水溶液中,是一種弱酸,由金屬離子和硝酸根離子組成的化合物,硝酸鹽極易溶於水,所以溶液中硝酸根不與其他陽離子反應,硝酸鹽大量存在於自然界中,主要來源是固氮菌固氮形成,或在閃電的高溫下空氣中的氮氣與氧氣直接化合成氮氧化物,溶於雨水形成硝酸,在與地面的礦物反應生成硝酸鹽。重要的有亞硝酸鈉、亞硝酸鉀等。大多是晶體。有致癌作用,需注意安全。用於制染料、藥物,並用作試劑。可由硝酸鹽加熱或與金屬鉛共熔而製得。

亞硝酸
分子量:47.013
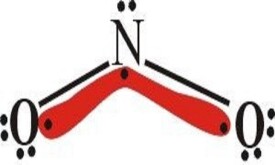
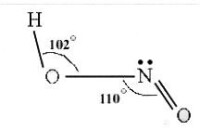
鍵長:N—OH為143pm,N—O為118pm。
鍵角:HON為102°,ONO為111°。
外觀與性狀:無色液體。
密度:1.54±0.1 g/cm3(Predicted)
弱酸性
HNO2是弱酸,但酸性比醋酸略強:
HNO2↔ H+ NO2
亞硝酸HNO2是不穩定的酸,只能存在於稀的水溶液中,臨用前以NaNO2的冷稀溶液與H2SO4作用而製得:
NaNO2+ H2SO4= NaHSO4+ HNO2
亞硝酸是比醋酸稍強的弱酸,它的電離平衡常數為4.6x10。亞硝酸溶液遇微熱即分解:
2HNO2= NO + NO2+ H2O
氧化性
亞硝酸及其鹽中N原子具有中間氧化態+3,雖然它們既具有氧化性又具有還原性,但以氧化性為主,而且它的氧化能力在稀溶液時比NO3離子還強,這一點可從它們在酸性溶液中的標準電極電勢值看出:
酸性溶液中HNO2的ψθ值:
HNO2+ H+ e↔ NO + H2O ψθ= +0.99V
酸性溶液中HNO3的ψθ值:
NO3+ 4H+ 3e↔ NO + 2H2O ψθ= +0.95V
在酸性溶液中,HNO2的ψθ值比HNO3的高,所以在稀溶液中NO2可以將I氧化成單質I2,而NO3卻不能氧化I,這是NO2與NO3離子的重要區別之一。這個反應可用於鑒定NO2離子。
2HNO2+ 2I+ 2H→ 2NO + I2+ 2H2O
還原性
5NO2+ 2MnO4+ 6H→5NO3+ 2Mn+ 3H2O
NO2+Cl2+ H2O → NO3+ 2H+ 2Cl
在鹼性溶液中NO2的還原性是主要的,空氣中的氧就能把NO2氧化成NO3。
鹼性溶液中NO2和O2的ψθ值如下:
NO3+ H2O + 2e↔ NO2+ 2OH ψθ=+0.01V
NO2+ H2O +e↔ NO + 2OH ψθ =-0.46V
O2+ 2H2O + 4e↔ 4OH ψθ =+0.401V
2NO2+ O2→ 2NO3
易生成配位化合物
在NO2離子中,N原子和O原子上都有孤電子對,它們能分別與許多過渡金屬離子生成配位鍵,形成配位化合物,例如[Co(NO2)4]3和[Co(NO2)(NH3)5]2等,它與K離子生成黃色的K3[Co(NO2)6]沉澱、此方法可用於鑒定K離子的存在:
3K+ [Co(NO2)6]→ K3[Co(NO2)6]↓(黃色)
熱穩定性
亞硝酸鹽具有很高的熱穩定性,可用金屬在高溫下還原硝酸鹽的方法來製備亞硝酸鹽:
Pb(粉) + NaNO3→ PbO + NaNO2
亞硝酸鹽除黃色的AgNO2不溶於水外,一般都易溶於水。
結構
在HNO2分子中,N原子採取sp雜化,生成兩個σ鍵、一個π鍵,還有一對孤電子對,NO2離子為平面三角形結構,N的氧化數為+3。HNO2有兩種結構:順式和反式。一般來講,反式結構比順式結構穩定。
亞硝酸
3HNO2 → HNO3 + H2O + 2NO
2、氧化還原標準電極電勢為:
NO2(g) + H+ + e- = HNO2 , E°= 1.093 V (還原劑)
HNO2 + H+ + e- = NO(g) + H2O , E°= 0.996 V (氧化劑)
3、脂肪伯胺與亞硝酸反應生成相應的醇,並放出氮氣。
4、芳香伯胺與亞硝酸在低溫和酸性條件下發生重氮化反應,產物重氮鹽不穩定,遇熱分解成為酚與氮氣。
5、脂肪仲胺和芳香仲胺與亞硝酸反應生成N-亞硝基胺,其是不溶於水的黃色油狀物或固體。
6、脂肪叔胺和亞硝酸只形成不穩定的鹽。
7、芳香叔胺如N,N-二甲苯胺在酸性條件下可與亞硝酸反應生成4-亞硝基-N,N-二甲苯胺,其為綠色沉澱。
必須在冷溶液中製備。
將二氧化氮和氧化氮的混合物溶解在接近零度的水中,即生成亞硝酸的水溶液:
NO2+NO+H2O─→2HNO2
在亞硝酸鹽溶液中加入酸,也可得到亞硝酸的溶液:
NaNO2+HCl─→HNO2+NaCl
亞硝酸在工業上用於有機合成,使胺類轉變成重氮化合物,從而製備偶氮染料。
亞硝酸有順式和反式之分,其中反式亞硝酸比順式亞硝酸更穩定。
通過亞硝酸鹽與酸反應製備:
Ba(NO2)2+ H2SO4→ 2HNO2+ BaSO4
AgNO2+ HCl → HNO2+ AgCl↓
用冰水充分冷卻下,將Ba(NO2)2(或AgNO2)溶於水中,加入稀硫酸(或稀鹽酸)。過濾除去析出的BaSO4(或AgCl)沉澱,亞硝酸留在溶液中。若溶液中有鹽存在也無關係時,在低於0℃下,用鹽酸酸化亞硝酸鈉即可。
亞硝酸
總反應為:
3Fe2++NO3-+4H+→3Fe3++NO+2H2O
雖然該反應已有很久的歷史,但其機理卻是不久前經分光光度法及電位滴定法的系統研究后才弄清楚的:
Fe2++NO3-+2H+→Fe3++NO2+H2O
Fe2++NO2+H+→Fe3++HNO2
Fe2++HNO2+H+→Fe3++NO+H2O
Fe2++NO→FeNO2+
2NO2+H2O→HNO2+NO3-+H+
2HNO2→NO+NO2+H2O
NO+NO3-+H+→NO2+HNO2
其中棕色環是由FeNO2+(第四步)引起的,速控步則是最後一步。

亞硝酸
亞硝酸重要的有:硝酸鈉、硝酸鉀、硝酸銨、硝酸鈣、硝酸鉛、硝酸鈰等。
主要用途是供植物吸收的氮肥,氮元素不僅是氨基酸與蛋白質的主要成分,還可以合成葉綠素,促進光合作用,所以如果植物缺氮就會葉子枯黃。硝酸鈉和硝酸鈣是很好的氮肥。硝酸銨可作肥料,也可制炸藥。由硝酸作用於相應的金屬或金屬氧化物等而製得。無公害蔬菜硝酸鹽的含量應控制在一定範圍內。因此在栽培上施肥應圍繞著降低硝酸鹽含量而進行,故巧施肥是無公害蔬菜生產的關鍵。
硝酸鉀是制黑色火藥的原料。
亞硝酸
慎重選購:消費者應少購溫室里生長的“反季節蔬菜”。這種蔬菜營養低、口味差,硝酸鹽含量高,過多食用有損健康。應注意選購本地生長的蔬菜。一般來講,經長途販運而來的蔬菜,所含的硝酸鹽往往會成倍增多,要多食根莖和瓜果類蔬菜。
減害處理:對不放心的蔬菜,在食用前應作一定的減害處理,如日晒、漂洗和浸泡等。這些方法是降低菜體內殘留硝酸鹽的有效方法。
科學食用:所購蔬菜不宜長時間存放,多吃熟菜,含硝酸鹽量高的蔬菜應少作涼拌或半生不熟地吃。蔬菜製成熟菜后應儘快吃完,不宜隔夜存放。進食時要充分咀嚼,因為唾液也能使亞硝胺喪失對人體細胞的突變作用。