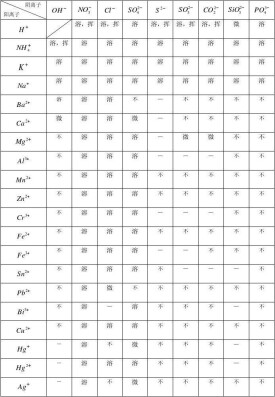
溶解度
物質的物理性質之一
溶解度,符號S,在一定溫度下,某固態物質在100g溶劑中達到飽和狀態時所溶解的溶質的質量,叫做這種物質在這種溶劑中的溶解度。物質的溶解度屬於物理性質。

溶解度
2.氣體的溶解度通常指的是該氣體(其壓強為1標準大氣壓)在一定溫度時溶解在1體積溶劑里的體積數。也常用“g/100g溶劑”作單位(自然也可用體積)。
3.特別注意:溶解度的單位是克(或者是克/100克溶劑)而不是沒有單位。
在一定的溫度和壓力下,物質在一定量的溶劑中溶解的最高量。一般以 100克溶劑中能溶解物質的克數來表示。一種物質在某種溶劑中的溶解度主要決定於溶劑和溶質的性質,即溶質在溶劑的溶解平衡常數。例如,水是最普通最常用的溶劑,甲醇和乙醇可以任何比例與水互溶。大多數鹼金屬鹽類都可以溶於水;苯幾乎不溶於水。
溶解度明顯受溫度的影響,大多數固體物質的溶解度隨溫度的升高而增大;氣體物質的溶解度則與此相反,隨溫度的升高而降低。溶解度與溫度的依賴關係可以用溶解度曲線來表示。氯化鈉NaCl的溶解度隨溫度的升高而緩慢增大,硝酸鉀的溶解度隨溫度的升高而迅速增大,而硫酸鈉的溶解度卻隨溫度的升高而減小。
固體和液體的溶解度基本不受壓力的影響,而氣體在液體中的溶解度與氣體的分壓成正比。物質的溶解度對於化學和化學工業都很重要,在固體物質的重結晶和分級結晶、化學物質的製備和分離、混合氣體的分離等工藝中都要利用物質溶解度的差別。
在一定溫度下,某物質在100g溶劑里達到飽和狀態(或稱溶解平衡)時所溶解的克數,叫做這種物質在這種溶劑里的溶解度。在一定溫度和壓強下,物質在一定量的溶劑中溶解的最大量,叫做這種物質在這種溶劑里的溶解度。溶解性是表示一種物質在另一種物質中的溶解能力,通常用易溶、可溶、微溶、難溶或不溶等粗略的概念來表示。溶解度是衡量物質在溶劑里溶解性大小的尺度,是溶解性的定量表示。
溶解度常用符號S表示。溶解度的單位用g/100g 表示。例如20℃,在100g水裡最多溶解36gNaCl,則氯化鈉在20℃的溶解度是36g/100g ,可表示為。實際上溶解度是沒有單位的相對比值,按法定計量單位,可用質量分數表示。例如在20℃,。溶解度也可以用飽和溶液的濃度表示。例如,氯化鉀在20℃的溶解度是(此濃度為質量摩爾濃度),即表示20℃在1000g水中最多可溶解4.627mol的氯化鉀。難溶物質的溶解度也可以用物質的量濃度(摩爾濃度)表示。例如在25℃,氫氧化鐵的物質的量濃度是0.45μmol/L,即表示1L氫氧化鐵飽和溶液里含0.45μmol氫氧化鐵。多數固體物質的溶解度隨溫度的上升而增大,如氯化銨、硝酸鉀。少數物質的溶解度受溫度變化的影響很小,如氯化鈉。含有結晶水的硫酸鈉()的溶解度開始隨溫度的升高而增大,當達到一定溫度(32.4℃)時,隨溫度的升高而減小(這時脫水成)。含有結晶水的氫氧化鈣和醋酸鈣等物質的溶解度隨溫度的升高而減小。氣體的溶解度隨溫度的升高而減小,隨壓強的增大而增大。影響溶解度的因素為溫度。
固體物質的能容溶解度是指在一定的溫度下,某物質在100克溶劑里達到飽和狀態時所溶解的質量,用字母s表示,其單位是“g/100g水”。在未註明的情況下,通常溶解度指的是物質在水裡的溶解度。例如:在20℃時,100g水裡最多能溶36g氯化鈉(這時溶液達到飽和狀態),在20℃時,氯化鈉在水裡的溶解度是36g。
在一定溫度和壓強下,氣體在一定量溶劑中溶解的最高量稱為氣體的溶解度。常用定溫下1體積溶劑中所溶解的最多體積數來表示。如20℃時100mL水中能溶解1.82mL氫氣,則表示為1.82mL/100mL水等。氣體的溶解度除與氣體本性、溶劑性質有關外,還與溫度、壓強有關,其溶解度一般隨著溫度升高而減少,由於氣體溶解時體積變化很大,故其溶解度隨壓強增大而顯著增大。關於氣體溶解於液體的溶解度,在1803年英國化學家W.亨利,根據對稀溶液的研究總結出一條定律,稱為亨利定律。
【提示】如果不指明溶劑,通常所說的溶解度是指物質在水裡的溶解度。另外,溶解度不同於溶解速度。攪拌、振蕩、粉碎顆粒等增大的是溶解速度,但不能增大溶解度。溶解度也不同於溶解的質量,溶劑的質量增加,能溶解的溶質質量也增加,但溶解度不會改變。
大部分固體隨溫度升高溶解度增大,如硝酸鉀。
少部分固體溶解度受溫度影響不大,如食鹽(氯化鈉)。
極少數物質溶解度隨溫度升高反而減小,如氫氧化鈣。因為氫氧化鈣有兩種水合物〔和〕。這兩種水合物的溶解度較大,無水氫氧化鈣的溶解度很小。隨著溫度的升高,這些結晶水合物逐漸變為無水氫氧化鈣,所以,氫氧化鈣的溶解度就隨著溫度的升高而減小。除了氫氧化鈣還有別的物質溶解度也隨溫度的升高而減小,比如說硫酸鋰。
物質溶解與否,溶解能力的大小,一方面決定於物質(指的是溶劑和溶質)的本 性;另一方面也與外界條件如溫度、壓強、溶劑種類等有關。在相同條件下,有些物質易於溶解,而有些物質則難於溶解,即不同物質在同一溶劑里溶解能力不同。通常把某一物質溶解在另一物質里的能力稱為溶解性。例如,糖易溶於水,而油脂不溶於水,就是它們對水的溶解性不同。溶解度是溶解性的定量表示。
性;另一方面也與外界條件如溫度、壓強、溶劑種類等有關。在相同條件下,有些物質易於溶解,而有些物質則難於溶解,即不同物質在同一溶劑里溶解能力不同。通常把某一物質溶解在另一物質里的能力稱為溶解性。例如,糖易溶於水,而油脂不溶於水,就是它們對水的溶解性不同。溶解度是溶解性的定量表示。

溶解度
在未註明的情況下,通常溶解度指的是物質在水裡的溶解度。如20℃時,食鹽的溶解度是36克,氯化鉀的溶解度是34克。這些數據可以說明20℃時,食鹽和氯化鉀在100克水裡最大的溶解量分別為36克和34克;也說明在此溫度下,食鹽在水中比氯化鉀的溶解能力強。
通常把在室溫(20°C)下,溶解度在10g/100g水以上的物質叫易溶物質,溶解度在1~10g/100g水叫可溶物質,溶解度在0.01g~1g/100g水的物質叫微溶物質,溶解度小於0.01g/100g水的物質叫難溶物質。可見溶解是絕對的,不溶解是相對的.
氣體的溶解度還和壓強有關。壓強越大,溶解度越大,反之則越小。
其他條件一定時,溫度越高,氣體溶解度越低。
每份(通常是每份質量)溶劑(有時可能是溶液)所能溶解的溶質的量的最 大值就是溶質在這種溶劑的溶解度。如果不指明溶劑,通常意味著溶劑為水,比如“氯化鈉的溶解度”和“氯化鈉在水中的溶解度”可以認為是具有同樣的意思。溶解度並不是一個恆定的值。一種溶質在溶劑中的溶解度由它們的分子間作用力、溫度、溶解過程中所伴隨的熵的變化以及其他物質的存在及多少,有時還與氣壓或氣體溶質的分壓有關。因此,一種物質的溶解度最好能夠表述成:“在某溫度,某氣壓下,某物質在某物質中的溶解度為xxxx。”,如無指明,則溫度及氣壓通常指的是標準狀況(STP)。
大值就是溶質在這種溶劑的溶解度。如果不指明溶劑,通常意味著溶劑為水,比如“氯化鈉的溶解度”和“氯化鈉在水中的溶解度”可以認為是具有同樣的意思。溶解度並不是一個恆定的值。一種溶質在溶劑中的溶解度由它們的分子間作用力、溫度、溶解過程中所伴隨的熵的變化以及其他物質的存在及多少,有時還與氣壓或氣體溶質的分壓有關。因此,一種物質的溶解度最好能夠表述成:“在某溫度,某氣壓下,某物質在某物質中的溶解度為xxxx。”,如無指明,則溫度及氣壓通常指的是標準狀況(STP)。

溶解度
實際上,溶解度往往取決於溶質在水中的溶解平衡常數。這是平衡常數的一種,反映溶質的溶解-沉澱平衡關係,當然它也可以用於沉澱過程(那時它叫溶度積)。因此,溶解度與溫度關係很大,也就不難解釋了。達到化學平衡的溶液便不能容納更多的溶質(當然,其他溶質仍能溶解),我們稱之為飽和溶液。在特殊條件下,溶液中溶解的溶質會比正常情況多,這時它便成為過飽和溶液。在一定溫度和壓力下,物質在一定量溶劑中溶解的最大量。
固體或液體溶質的溶解度,常用100克溶劑中所溶解的溶質克數表示。例如在20℃和常壓下,硝酸鉀在水中的溶解度是31.5克/100克水,或簡稱31.5克。氣體溶質的溶解度,常用每毫升溶劑中所溶解的氣體毫升數表示。例如在20℃和常壓下,氨的溶解度是700毫升/1毫升水。物質的溶解度除與溶質和溶劑的性質有關外,還與溫度、壓力等條件有關。隨著溫度的升高,大多數固體和液體的溶解度增大,氣體的則減小。隨著壓力的增大,氣體的溶解度增大。
氣體的溶解度大小,首先決定於氣體的性質,同時也隨著氣體的壓強和溶劑的溫度的不同而變化。例如,在20℃時,氣體的壓強為,一升水可以溶解氣體的體積是:氨氣為702L,氫氣為0.01819L,氧氣為0.03102L。氨氣易溶於水,是因為氨氣是極性分子,水也是極性分子,而且氨氣分子跟水分子還能形成氫鍵,發生顯著的水合作用,所以,它的溶解度很大;而氫氣、氧氣都是非極性分子,所以在水裡的溶解度很小。
當壓強一定時,氣體的溶解度隨著溫度的升高而減少。這一點對氣體來說沒有例外,因為當溫度升高時,氣體分子運動速率加快,容易自水面逸出。
當溫度一定時,氣體的溶解度隨著氣體的壓強的增大而增大。這是因為當壓強增大時,液面上的氣體的濃度增大,因此,進入液面的氣體分子比從液面逸出的分子多,從而使氣體的溶解度變大。而且,氣體的溶解度和該氣體的壓強(分壓)在一定範圍內成正比(在氣體不跟水發生化學變化的情況下)。例如,在20℃時,氫氣的壓強是 ,氫氣在一升水裡的溶解度是0.01819L;同樣在20℃,在 時,氫氣在一升水裡的溶解度是0.01819×2=0.03638L。
氣體的溶解度有兩種表示方法,一種是在一定溫度下,氣體的壓強(或稱該氣體的分壓,不包括水蒸氣的壓強)是 時,溶解於一體積水裡,達到飽和的氣體的體積(並需換算成在0℃時的體積數),即這種氣體在水裡的溶解度。另一種氣體的溶解度的表示方法是,在一定溫度下,該氣體在100g水裡,氣體的總壓強為 (氣體的分壓加上當時水蒸氣的壓強)所溶解的克數。
夏天打開汽水瓶蓋時,壓強減小,氣體的溶解度減小,會有大量氣體湧出。
喝汽水後會打嗝,因為汽水到胃中后,溫度升高,氣體的溶解度減小。
溶解度曲線的意義與應用可從點、線、面和交點四方面來分析。
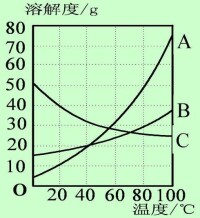
溶解度
溶解度曲線上的每個點表示的是某溫度下某種物質的溶解度。即曲線上的任意一點都對應有相應的溫度和溶解度。溫度在橫坐標上可以找到,溶解度在縱坐標上可以找到。溶解度曲線上的點有三個方面的作用: (1)根據已知溫度查出有關物質的溶解度;(2)根據物質的溶解度查出對應的溫度;(3)比較相同溫度下不同物質溶解度的大小或者飽和溶液中溶質的質量分數的大小。
2.線
溶解度曲線表示某物質在不同溫度下的溶解度或溶解度隨溫度的變化情況。曲線的坡度越大,說明溶解度受溫度影響越大;反之,說明受溫度影響較小。溶解度曲線也有三個方面的應用:(1)根據溶解度曲線,可以看出物質的溶解度隨著溫度的變化而變化的情況。 (2)根據溶解度曲線,比較在一定溫度範圍內的物質的溶解度大小。 (3)根據溶解度曲線,選擇分離某些可溶性混合物的方法。
3.面
對於曲線下部面積上的任何點,依其數據配製的溶液為對應溫度時的不飽 和溶液;曲線上部面積上的點,依其數據配製的溶液為對應溫度時的飽和溶液,且溶質有剩餘。如果要使不飽和溶液(曲線下部的一點)變成對應溫度下的飽和溶液,方法有兩種:第一種方法是向該溶液中添加溶質使之到達曲線上;第二種方法是蒸發一定量的溶劑。
和溶液;曲線上部面積上的點,依其數據配製的溶液為對應溫度時的飽和溶液,且溶質有剩餘。如果要使不飽和溶液(曲線下部的一點)變成對應溫度下的飽和溶液,方法有兩種:第一種方法是向該溶液中添加溶質使之到達曲線上;第二種方法是蒸發一定量的溶劑。

溶解度
4.交點
兩條溶解度曲線的交點表示該點所示的溫度下兩物質的溶解度相同,此時兩種物質飽和溶液的溶質質量分數也相同。
常見氣體溶解度
,一氧化碳
(極易溶解於水) (易溶解於水) (能溶解於水) (難) (極難)
(1)大部分固體物質的溶解度曲線左低右高,溶解度隨溫度的升高而增加;
(2)少數固體物質的溶解度曲線較平緩,溶解度受溫度的影響小,如食鹽;
(3)極少數固體物質的溶解度曲線是左高右低,溶解度隨溫度的升高而降低,如熟石灰;
用溶解性表示物質的溶解能力是定性的,粗略的。
(l)由已知溫度查某物質對應的溶解度;
(2)由物質的溶解度查該物質所處的溫度;
(3)比較同一溫度下不同物質的溶解度;比較同一物質在不同溫度下的溶解度。
(4)比較和確定物質的溶解度受溫度影響的程度,並據此設計混合物分離或提純的方法,例如提純可用蒸發溶劑法,分離NaCl和可用降溫結晶法。
(5) 能夠判斷在一定溫度下某物質飽和溶液中溶質、溶劑、溶液的質量比。
(6)判斷在一定溫度下把一定量的溶質溶解在一定量的溶劑里所形成的溶液是否為飽和溶液。
(7)根據物質在20攝氏度的溶解度來確定物質的溶解度大小。
(8)確定溶液的狀態(飽和與不飽和)。
大致包括以下四種類型:
(1)已知溶質和溶劑的量,求溶質的質量分數;
(2)要配製一定量的溶質的質量分數一定的溶液,計算所需溶質和溶劑的量;
(3)溶液稀釋和配製問題的計算;
(4)把溶質的質量分數運用於化學方程式的計算。
溶質的質量分數的計算方式:
例 10克氯化鈉溶解於90克水中,則在所得氯化鈉溶液中溶質的質量分數
根據稀釋前後溶質的總量不變進行運算,無論是用水,或是用稀溶液來稀釋濃溶液,都可計算。
(1)用水稀釋濃溶液
設稀釋前的濃溶液的質量為m,其溶質的質量分數為a%,稀釋時加入水的質量為n,稀釋后溶質的質量分數為b%。
則可得
(2)用稀溶液稀釋濃溶液
設濃溶液的質量為A,其溶質的質量分數為a%,稀溶液的質量為B,其溶質的質量分數為b%,兩液混合后的溶質的質量分數為c%。
則可得 (1)
或 (2)
固體溶解度之一
在一定溫度下,某固態物質在100g溶劑里達到飽和時所溶解的克數,叫做這種物質在這種溶劑里的溶解度。符號:S
固體溶解度之二
在一定溫度下,一定量的飽和溶液中含有固體溶質的量稱為該固體物質在 指定溫度下的溶解度。通常以一定溫度下,物質在100g溶劑中達到飽和時所溶解的克數來表示某物質在該溶劑中的溶解度,如20℃時,100g水中最多能溶解35.8g氯化鈉,即該溫度下氯化鈉的溶解度為35.8g/100g水。
指定溫度下的溶解度。通常以一定溫度下,物質在100g溶劑中達到飽和時所溶解的克數來表示某物質在該溶劑中的溶解度,如20℃時,100g水中最多能溶解35.8g氯化鈉,即該溫度下氯化鈉的溶解度為35.8g/100g水。

溶解度
固體物質的溶解度與溶質、溶劑的本性有關,通常溶質的結構與溶劑的結構相似時較易溶解,即所謂相似相溶原理,它可解釋部分事實。大多數固體物質的溶解度隨溫度升高而增大,溫度對不同的物質影響不同,可根據物質溶解度與溫度的關係作出溶解度曲線,利用溶解度曲線可找出在任何溫度時,某物質的溶解度,也可利用溶解度曲線提純、分離某些物質。固體物質的溶解度受壓力影響較小。
物質的溶解性
溶解性 溶解度(20℃)
易溶 大於等於10g
可溶 大於等於1g小於10g
微溶 大於等於0.01g小於1g
難溶(不溶)小於0.01g
錒、氨、銨
| 物質 | 化學式 | 0°C | 10°C | 20°C | 30°C | 40°C | 50°C | 60°C | 70°C | 80°C | 90°C | 100°C |
| 氫氧化錒(III) | 0.0022 | |||||||||||
| 氨 | 88.5 | 70 | 56 | 44.5 | 34 | 26.5 | 20 | 15 | 11 | 8 | 7 | |
| 疊氮化銨 | 16 | 25.3 | 37.1 | |||||||||
| 苯甲酸銨 | 20 | |||||||||||
| 碳酸氫銨 | NH₄HCO₃ | 11.9 | 16.1 | 21.7 | 28.4 | 36.6 | 59.2 | 109 | 170 | 354 | ||
| 溴化銨 | 60.6 | 68.1 | 76.4 | 83.2 | 91.2 | 108 | 125 | 135 | 145 | |||
| 碳酸銨 | 100 | |||||||||||
| 氯酸銨 | 28.7 | |||||||||||
| 氯化銨 | 29.4 | 33.2 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 60.2 | 65.6 | 71.2 | 77.3 | |
| 氯鉑酸銨 | 0.289 | 0.374 | 0.499 | 0.637 | 0.815 | 1.44 | 2.16 | 2.61 | 3.36 | |||
| 鉻酸銨 | 25 | 29.2 | 34 | 39.3 | 45.3 | 59 | 76.1 | |||||
| 重鉻酸銨 | 18.2 | 25.5 | 35.6 | 46.5 | 58.5 | 86 | 115 | 156 | ||||
| 砷酸二氫銨 | 33.7 | 48.7 | 63.8 | 83 | 107 | 122 | ||||||
| 磷酸二氫銨 | 22.7 | 39.5 | 37.4 | 46.4 | 56.7 | 82.5 | 118 | 173 | ||||
| 氟硅酸銨 | 18.6 | |||||||||||
| 甲酸銨 | 102 | 143 | 204 | 311 | 533 | |||||||
| 磷酸一氫銨 | 42.9 | 62.9 | 68.9 | 75.1 | 81.8 | 97.2 | ||||||
| 硫酸氫銨 | 100 | |||||||||||
| 酒石酸氫銨 | 1.88 | 2.7 | ||||||||||
| 碘酸銨 | NH4IO3 | 2.6 | ||||||||||
| 碘化銨 | NH4I | 155 | 163 | 172 | 182 | 191 | 209 | 229 | 250 | |||
| 硝酸銨 | NH4NO3 | 118 | 150 | 192 | 242 | 297 | 421 | 580 | 740 | 871 | ||
| 高碘酸銨 | (NH4)5IO6 | 2.7 | ||||||||||
| 草酸銨 | (NH4)2C2O4 | 2.2 | 3.21 | 4.45 | 6.09 | 8.18 | 14 | 22.4 | 27.9 | 34.7 | ||
| 高氯酸銨 | NH4ClO4 | 12 | 16.4 | 21.7 | 37.7 | 34.6 | 49.9 | 68.9 | ||||
| 高錳酸銨 | NH4MnO4 | 7.9 | ||||||||||
| 磷酸銨 | (NH4)3PO4 | 26.1 | ||||||||||
| 硒酸銨 | (NH4)2SeO4 | 96 | 105 | 115 | 126 | 143 | 192 | |||||
| 硫酸銨 | (NH4)2SO4 | 70.6 | 73 | 75.4 | 78 | 81 | 88 | 95 | 103 | |||
| 亞硫酸銨 | (NH4)2SO3 | 47.9 | 54 | 60.8 | 68.8 | 78.4 | 104 | 144 | 150 | 153 | ||
| 酒石酸銨 | (NH4)2C4H4O6 | 45 | 55 | 63 | 70.5 | 76.5 | 86.9 | |||||
| 硫氰酸銨 | NH4SCN | 120 | 144 | 170 | 208 | 234 | 346 | |||||
| 硫代硫酸銨 | (NH4)2S2O3 | 2.15 | ||||||||||
| 釩酸銨 | NH4VO3 | 0.48 | 0.84 | 1.32 | 2.42 |
鈀、鋇、鉍、鉑、鈈
| 物質 | 化學式 | 0°C | 10°C | 20°C | 30°C | 40°C | 50°C | 60°C | 70°C | 80°C | 90°C | 100°C |
| 氫氧化鈀(II) | Pd(OH)2 | 4.106×10 | ||||||||||
| 氫氧化鈀(IV) | Pd(OH)4 | 5.247×10 | ||||||||||
| 乙酸鋇 | Ba(C2H3O2)2 | 58.8 | 62 | 72 | 75 | 78.5 | 75 | 74 | 74.8 | |||
| 砷酸鋇 | Ba3(AsO4)2 | 2.586×10 | ||||||||||
| 疊氮化鋇 | Ba(N3)2 | 12.5 | 16.1 | 17.4 | ||||||||
| 溴酸鋇 | Ba(BrO3)2 | 0.29 | 0.44 | 0.65 | 0.95 | 1.31 | 2.27 | 3.52 | 0.95 | 1.31 | ||
| 溴化鋇 | BaBr2 | 98 | 101 | 104 | 109 | 114 | 123 | 135 | 149 | |||
| 碳酸鋇 | BaCO3 | 1.409×10 | ||||||||||
| 氯酸鋇 | Ba(ClO3)2 | 20.3 | 26.9 | 33.9 | 41.6 | 49.7 | 66.7 | 84.8 | 105 | |||
| 氯化鋇 | BaCl2 | 31.2 | 33.5 | 35.8 | 38.1 | 40.8 | 46.2 | 52.5 | 55.8 | 59.4 | ||
| 氯酸鋇 | Ba(ClO2)2 | 43.9 | 44.6 | 45.4 | 47.9 | 53.8 | 66.6 | 80.8 | ||||
| 鉻酸鋇 | BaCrO4 | 2.775×10 | ||||||||||
| 氰化鋇 | Ba(CN)2 | 80 | ||||||||||
| 亞鐵氰化鋇 | Ba2Fe(CN)6 | 9.732×10 | ||||||||||
| 氟化鋇 | BaF2 | 0.159 | 0.16 | 0.162 | ||||||||
| 氟硅酸鋇 | BaSiF6 | 2.8×10 | ||||||||||
| 甲酸鋇 | Ba(HCO2)2 | 26.2 | 28 | 31.9 | 34 | 38.6 | 44.2 | 47.6 | 51.3 | |||
| 磷酸氫鋇 | BaHPO4 | 1.3×10 | ||||||||||
| 亞磷酸氫鋇 | BaHPO3 | 0.687 | ||||||||||
| 氫氧化鋇 | Ba(OH)2·8H2O | 1.67 | 2.48 | 3.89 | 5.59 | 8.22 | 20.9 | 101 | ||||
| 碘酸鋇 | Ba(IO3)2 | 3.5×10 | 4.6×10 | 5.7×10 | ||||||||
| 碘化鋇 | BaI2 | 182 | 201 | 223 | 250 | 264 | 291 | 301 | ||||
| 鉬酸鋇 | BaMoO4 | 6×10 | ||||||||||
| 硝酸鋇 | Ba(NO3)2 | 4.95 | 6.67 | 9.02 | 11.5 | 14.1 | 20.4 | 27.2 | 34.4 | |||
| 亞硝酸鋇 | Ba(NO2)2 | 50.3 | 60 | 72.8 | 102 | 151 | 222 | 261 | 325 | |||
| 草酸鋇 | BaC2O4·2H2O | 3×10 | ||||||||||
| 氧化鋇 | BaO | 3.8 | ||||||||||
| 高氯酸鋇 | Ba(ClO4)2 | 239 | 336 | 416 | 495 | 575 | 653 | |||||
| 高錳酸鋇 | Ba(MnO4)2 | 1.5×10 | ||||||||||
| 焦磷酸鋇 | Ba2P2O7 | 9×10 | ||||||||||
| 硒酸鋇 | BaSeO4 | 5×10 | ||||||||||
| 硫酸鋇 | BaSO4 | 2.448×10 | ||||||||||
| 硫化鋇 | BaS | 2.88 | 4.89 | 7.86 | 10.4 | 14.9 | 27.7 | 49.9 | 67.3 | 60.3 | ||
| 砷酸鉍 | BiAsO4 | 7.298×10 | ||||||||||
| 氫氧化鉍 | Bi(OH)3 | 2.868×10 | ||||||||||
| 碘化鉍 | BiI3 | 7.761×10 | ||||||||||
| 磷酸鉍 | BiPO4 | 1.096×10 | ||||||||||
| 硫化鉍 | Bi2S3 | 1.561×10 | ||||||||||
| 氫氧化鉑(II) | Pt(OH)2 | 3.109×10 | ||||||||||
| 溴化鉑(IV) | PtBr4 | 1.352×10 | ||||||||||
| 氟化鈈(III) | PuF3 | 3.144×10 | ||||||||||
| 氟化鈈(IV) | PuF4 | 3.622×10 | ||||||||||
| 碘酸鈈(IV) | Pu(IO3)4 | 7.998×10 |
氮、鏑
| 物質 | 化學式 | 0°C | 10°C | 20°C | 30°C | 40°C | 50°C | 60°C | 70°C | 80°C | 90°C | 100°C |
| 一氧化氮 | NO | 5.6×10 | ||||||||||
| 一氧化二氮 | N2O | 0.112 | ||||||||||
| 鉻酸鏑(III) | Dy2(CrO4)3·10H2O | 0.663 |
鉺
| 物質 | 化學式 | 0°C | 10°C | 20°C | 30°C | 40°C | 50°C | 60°C | 70°C | 80°C | 90°C | 100°C |
| 氫氧化鉺(III) | Er(OH)3 | 1.363×10 |
釩
| 物質 | 化學式 | 0°C | 10°C | 20°C | 30°C | 40°C | 50°C | 60°C | 70°C | 80°C | 90°C | 100°C |
| 五氧化二釩 | V2O5 | 0.8 |
釓、鈣、鋯、鎘、鉻、汞、鈷、硅
| 物質 | 化學式 | 0°C | 10°C | 20°C | 30°C | 40°C | 50°C | 60°C | 70°C | 80°C | 90°C | 100°C |
| 乙酸釓(III) | Gd(C2H3O2) ·4H2O | 11.6 | ||||||||||
| 碳酸氫釓(III) | Gd(HCO3)3 | 5.61 | ||||||||||
| 溴酸釓(III) | Gd(BrO3)3 ·9H2O | 50.2 | 70.1 | 95.6 | 126 | 166 | ||||||
| 氫氧化釓(III) | Gd(OH)3 | 1.882×10 | ||||||||||
| 硫酸釓(III) | Gd2(SO4)3 | 3.98 | 3.3 | 2.6 | 2.32 | |||||||
| 氯化鈣 | CaCl2 | 59.5 | 64.7 | 74.5 | 100 | 128 | 137 | 147 | 154 | 159 | ||
| 乙酸鈣 | Ca(C2H3O2)2 ·2H2O | 37.4 | 36 | 34.7 | 33.8 | 33.2 | 32.7 | 33.5 | 31.1 | 29.7 | ||
| 砷酸鈣 | Ca3(AsO4)2 | 3.629×10 | ||||||||||
| 疊氮化鈣 | Ca(N3)2 | 45 | ||||||||||
| 苯甲酸鈣 | Ca(C7H5O2)2 ·3H2O | 2.32 | 2.45 | 2.72 | 3.02 | 3.42 | 4.71 | 6.87 | 8.55 | 8.7 | ||
| 碳酸氫鈣 | Ca(HCO3)2 | 16.1 | 16.6 | 17.1 | 17.5 | 17.9 | 18.4 | |||||
| 溴酸鈣 | Ca(BrO3)2 | 230 | ||||||||||
| 溴化鈣 | CaBr2 | 125 | 132 | 143 | 213 | 278 | 295 | 312 | ||||
| 霰石 | CaCO3-霰石 | 7.753×10 | ||||||||||
| 方解石 | CaCO3-方解石 | 6.170×10 | ||||||||||
| 氯酸鈣 | Ca(ClO3)2 | 209 | ||||||||||
| 鉻酸鈣 | CaCrO4 | 4.5 | 2.25 | 1.83 | 1.49 | 0.83 | ||||||
| 磷酸二氫鈣 | Ca(H2PO4)2 | 1.8 | ||||||||||
| 氟化鈣 | CaF2 | 8.575×10 | ||||||||||
| 氟硅酸鈣 | CaSiF6 | 0.518 | ||||||||||
| 甲酸鈣 | Ca(HCO2)2 | 16.1 | 16.6 | 17.1 | 17.5 | 17.9 | 18.4 | |||||
| 磷酸氫鈣 | CaHPO4 | 4.303×10 | ||||||||||
| 氫氧化鈣 | Ca(OH)2 | 0.189 | 0.182 | 0.173 | 0.16 | 0.141 | 0.121 | 8.6×10 | 7.6×10 | |||
| 碘酸鈣 | Ca(IO3)2 | 9×10 | 0.24 | 0.38 | 0.52 | 0.65 | 0.66 | 0.67 | ||||
| 碘化鈣 | CaI2 | 64.6 | 66 | 67.6 | 70.8 | 74 | 78 | 81 | ||||
| 鉬酸鈣 | CaMoO4 | 4.099×10 | ||||||||||
| 硝酸鈣 | Ca(NO3)2 ·4H2O | 102 | 115 | 129 | 152 | 191 | 358 | 363 | ||||
| 亞硝酸鈣 | Ca(NO2)2 ·4H2O | 63.9 | 84.5 | 104 | 134 | 151 | 166 | 178 | ||||
| 草酸鈣 | CaC2O4 | 6.7×10 | ||||||||||
| 高氯酸鈣 | Ca(ClO4)2 | 188 | ||||||||||
| 高錳酸鈣 | Ca(MnO4)2 | 338 | ||||||||||
| 磷酸鈣 | Ca3(PO4)2 | 2×10 | ||||||||||
| 硒酸鈣 | CaSeO4·2H2O | 9.73 | 9.77 | 9.22 | 8.79 | 7.14 | ||||||
| 硫酸鈣 | CaSO4·2H2O | 0.223 | 0.244 | 0.255 | 0.264 | 0.265 | 0.244 | 0.234 | 0.205 | |||
| 鎢酸鈣 | CaWO4 | 2.387×10 | ||||||||||
| 氟化鋯 | ZrF4 | 1.32 | ||||||||||
| 硫酸鋯 | Zr(SO4)2·4H2O | 52.5 | ||||||||||
| 砷酸鎘 | Cd3(AsO4)2 | 7.091×10 | ||||||||||
| 苯甲酸鎘 | Cd(C7H5O2)2 | 2.81 | ||||||||||
| 溴酸鎘 | Cd(BrO3)2 | 125 | ||||||||||
| 溴化鎘 | CdBr2 | 56.3 | 75.4 | 98.8 | 129 | 152 | 153 | 156 | 160 | |||
| 碳酸鎘 | CdCO3 | 3.932×10 | ||||||||||
| 氯酸鎘 | Cd(ClO3)2 | 299 | 308 | 322 | 348 | 376 | 455 | |||||
| 氯化鎘 | CdCl2 | 100 | 135 | 135 | 135 | 135 | 136 | 140 | 147 | |||
| 氰化鎘 | Cd(CN)2 | 2.2×10 | ||||||||||
| 亞鐵氰化鎘 | Cd2Fe(CN)6 | 8.736×10 | ||||||||||
| 氟化鎘 | CdF2 | 4 | ||||||||||
| 甲酸鎘 | Cd(HCO2)2 | 8.3 | 11.1 | 14.4 | 18.6 | 25.3 | 59.5 | 80.5 | 85.2 | 94.6 | ||
| 氫氧化鎘 | Cd(OH)2 | 2.697×10 | ||||||||||
| 碘酸鎘 | Cd(IO3)2 | 9.7×10 | ||||||||||
| 碘化鎘 | CdI2 | 78.7 | 84.7 | 87.9 | 92.1 | 100 | 111 | 125 | ||||
| 硝酸鎘 | Cd(NO3)2 | 122 | 136 | 150 | 194 | 310 | 713 | |||||
| 草酸鎘 | CdC2O4.3H2O | 6.046×10 | ||||||||||
| 高氯酸鎘 | Cd(ClO4)2 | 180 | 188 | 195 | 203 | 221 | 243 | 272 | ||||
| 磷酸鎘 | Cd3(PO4)2 | 6.235×10 | ||||||||||
| 硒酸鎘 | CdSeO4 | 72.5 | 68.4 | 64 | 58.9 | 55 | 44.2 | 32.5 | 27.2 | 22 | ||
| 硫酸鎘 | CdSO4 | 75.4 | 76 | 76.6 | 78.5 | 81.8 | 66.7 | 63.1 | 60.8 | |||
| 硫化鎘 | CdS | 1.292×10 | ||||||||||
| 鎢酸鎘 | CdWO4 | 4.642×10 | ||||||||||
| 硝酸鉻 | Cr(NO3)3 | 108 | 124 | 130 | 152 | |||||||
| 高氯酸鉻 | Cr(ClO4)3 | 104 | 123 | 130 | ||||||||
| 硫酸鉻 | Cr2(SO4)3 ·18H2O | 220 | ||||||||||
| 疊氮化亞汞 | Hg2(N3)2 | 2.727×10 | ||||||||||
| 溴化亞汞 | Hg2Br2 | 1.352×10 | ||||||||||
| 碳酸亞汞 | Hg2CO3 | 4.351×10 | ||||||||||
| 氯化亞汞 | Hg2Cl2 | 3.246×10 | ||||||||||
| 鉻酸亞汞 | Hg2CrO4 | 2.313×10 | ||||||||||
| 氰化亞汞 | Hg2(CN)2 | 2.266×10 | ||||||||||
| 高氯酸亞汞 | Hg2(ClO4)2) | 282 | 325 | 407 | 455 | 499 | 541 | 580 | ||||
| 硫酸亞汞 | Hg2SO4 | 4.277×10 | ||||||||||
| 乙酸汞 | Hg(C2H3O2)2 | 25 | ||||||||||
| 苯甲酸汞 | Hg(C7H5O2)2 ·H2O | 1.1 | ||||||||||
| 溴酸汞 | Hg(BrO3)2 ·2H2O | 0.08 | ||||||||||
| 溴化汞 | HgBr2 | 0.3 | 0.4 | 0.56 | 0.66 | 0.91 | 1.68 | 2.77 | 4.9 | |||
| 氯酸汞 | Hg(ClO3)2 | 25 | ||||||||||
| 氯化汞 | HgCl2 | 3.63 | 4.82 | 6.57 | 8.34 | 10.2 | 16.3 | 30 | 61.3 | |||
| 氰化汞 | Hg(CN)2 | 9.3 | ||||||||||
| 碘酸汞 | Hg(IO3)2 | 2.372×10 | ||||||||||
| 碘化汞 | HgI2 | 6×10 | ||||||||||
| 草酸汞 | HgC2O4 | 1.1×10 | ||||||||||
| 硫化汞 | HgS | 2.943×10 | ||||||||||
| 硫氰酸汞 | Hg(SCN)2 | 6.3×10 | ||||||||||
| 溴酸鈷 | Co(BrO3)2 ·6H2O | 45.5 | ||||||||||
| 溴化鈷 | CoBr2 | 91.9 | 112 | 128 | 163 | 227 | 241 | 257 | ||||
| 氯酸鈷 | Co(ClO3)2 | 135 | 162 | 180 | 195 | 214 | 316 | |||||
| 氯化鈷 | CoCl2 | 43.5 | 47.7 | 52.9 | 59.7 | 69.5 | 93.8 | 97.6 | 101 | 106 | ||
| 氟化鈷 | CoF2 | 1.36 | ||||||||||
| 氟硅酸鈷 | CoSiF6 ·6H2O | 118 | ||||||||||
| 碘酸鈷 | Co(IO3)2 ·2H2O | 1.02 | 0.9 | 0.88 | 0.82 | 0.73 | 0.7 | |||||
| 碘化鈷 | CoI2 | 203 | ||||||||||
| 硝酸鈷 | Co(NO3)2 | 84 | 89.6 | 97.4 | 111 | 125 | 174 | 204 | 300 | |||
| 亞硝酸鈷 | Co(NO2)2 | 7.6×10 | 0.24 | 0.4 | 0.61 | 0.85 | ||||||
| 高氯酸鈷 | Co(ClO4)2 | 104 | ||||||||||
| 硫酸鈷 | CoSO4 | 25.5 | 30.5 | 36.1 | 42 | 48.8 | 55 | 53.8 | 45.3 | 38.9 | ||
| 二氧化硅 | SiO2 |
鉿、氦、鈥
| 物質 | 化學式 | 0°C | 10°C | 20°C | 30°C | 40°C | 50°C | 60°C | 70°C | 80°C | 90°C | 100°C |
| 氫氧化鉿(III) | Hf(OH)3 | 4.50305×10 | ||||||||||
| 氫氧化鉿(IV) | Hf(OH)4 | 4.503×10 | ||||||||||
| 氦 | He | 0.6 | ||||||||||
| 氫氧化鈥(III) | Ho(OH)3 | 2.519×10 | ||||||||||
| 硫酸鈥(III) | Ho2(SO4)3·8H2O | 8.18 | 6.1 | 4.52 |
鎵、鉀、金
| 物質 | 化學式 | 0°C | 10°C | 20°C | 30°C | 40°C | 50°C | 60°C | 70°C | 80°C | 90°C | 100°C |
| 氫氧化鎵 | Ga(OH)3 | 8.616×10 | ||||||||||
| 草酸鎵 | Ga2(C2O4)3·42O | 0.4 | ||||||||||
| 硒酸鎵 | Ga2(SeO4)3·16H2O | 18.1 | ||||||||||
| 乙酸鉀 | KC2H3O2 | 216 | 233 | 256 | 283 | 324 | 350 | 381 | 398 | |||
| 砷酸鉀 | K3AsO4 | 19 | ||||||||||
| 疊氮化鉀 | KN3 | 41.4 | 46.2 | 50.8 | 55.8 | 61 | 106 | |||||
| 苯甲酸鉀 | KC7H5O2 | 65.8 | 70.7 | 76.7 | 82.1 | |||||||
| 溴酸鉀 | KBrO3 | 3.09 | 4.72 | 6.91 | 9.64 | 13.1 | 22.7 | 34.1 | 49.9 | |||
| 溴化鉀 | KBr | 53.6 | 59.5 | 65.3 | 70.7 | 75.4 | 85.5 | 94.9 | 99.2 | 104 | ||
| 溴鉑酸鉀 | K2PtBr6 | 1.89 | ||||||||||
| 碳酸鉀 | K2CO3 | 105 | 109 | 111 | 114 | 117 | 127 | 140 | 148 | 156 | ||
| 氯酸鉀 | KClO3 | 3.3 | 5.2 | 7.3 | 10.1 | 13.9 | 23.8 | 37.5 | 46 | 56.3 | ||
| 氯化鉀 | KCl | 28 | 31.2 | 34.2 | 37.2 | 40.1 | 45.8 | 48.8 | 51.3 | 53.9 | 56.3 | |
| 鉻酸鉀 | K2CrO4 | 56.3 | 60 | 63.7 | 66.7 | 67.8 | 70.1 | 74.5 | ||||
| 氰化鉀 | KCN | 50 | ||||||||||
| 重鉻酸鉀 | K2Cr2O7 | 4.7 | 7 | 12.3 | 18.1 | 26.3 | 45.6 | 73 | ||||
| 砷酸二氫鉀 | KH2AsO4 | 19 | ||||||||||
| 磷酸二氫鉀 | KH2PO4 | 14.8 | 18.3 | 22.6 | 28 | 35.5 | 50.2 | 70.4 | 83.5 | |||
| 鐵氰化鉀 | K3Fe(CN)6 | 30.2 | 38 | 46 | 53 | 59.3 | 70 | 91 | ||||
| 亞鐵氰化鉀 | K4Fe(CN)6 | 14.3 | 21.1 | 28.2 | 35.1 | 41.4 | 54.8 | 66.9 | 71.5 | 74.2 | ||
| 氟化鉀 | KF | 44.7 | 53.5 | 94.9 | 108 | 138 | 142 | 150 | ||||
| 甲酸鉀 | KHCO2 | 313 | 337 | 361 | 398 | 471 | 580 | 658 | ||||
| 碳酸氫鉀 | KHCO3 | 22.5 | 27.4 | 33.7 | 39.9 | 47.5 | 65.6 | |||||
| 磷酸一氫鉀 | K2HPO4 | 150 | ||||||||||
| 硫酸氫鉀 | KHSO4 | 36.2 | 48.6 | 54.3 | 61 | 76.4 | 96.1 | 122 | ||||
| 氫氧化鉀 | KOH | 95.7 | 103 | 112 | 126 | 134 | 154 | 178 | ||||
| 碘酸鉀 | KIO3 | 4.6 | 6.27 | 8.08 | 10.3 | 12.6 | 18.3 | 24.8 | 32.3 | |||
| 碘化鉀 | KI | 128 | 136 | 144 | 153 | 162 | 168 | 176 | 192 | 198 | 206 | |
| 硝酸鉀 | KNO3 | 13.9 | 21.9 | 31.6 | 45.3 | 61.3 | 85.5 | 106 | 138 | 167 | 203 | 245 |
| 亞硝酸鉀 | KNO2 | 279 | 292 | 306 | 320 | 329 | 348 | 376 | 390 | 410 | ||
| 草酸鉀 | K2C2O4 | 25.5 | 31.9 | 36.4 | 39.9 | 43.8 | 53.2 | 63.6 | 69.2 | 75.3 | ||
| 高氯酸鉀 | KClO4 | 0.76 | 1.06 | 1.68 | 2.56 | 3.73 | 7.3 | 13.4 | 17.7 | 22.3 | ||
| 高碘酸鉀 | KIO4 | 0.17 | 0.28 | 0.42 | 0.65 | 1 | 2.1 | 4.4 | 5.9 | |||
| 高錳酸鉀 | KMnO4 | 2.83 | 4.31 | 6.34 | 9.03 | 12.6 | 22.1 | |||||
| 過二硫酸鉀 | K2S2O8 | 4.7 | ||||||||||
| 磷酸鉀 | K3PO4 | 81.5 | 92.3 | 108 | 133 | |||||||
| 硒酸鉀 | K2SeO4 | 107 | 109 | 111 | 113 | 115 | 119 | 121 | 122 | |||
| 硫酸鉀 | K2SO4 | 7.4 | 9.3 | 11.1 | 13 | 14.8 | 18.2 | 21.4 | 22.9 | 24.1 | ||
| 四苯硼鉀 | KBC24H20 | 1.8×10 | ||||||||||
| 硫氰酸鉀 | KSCN | 177 | 198 | 224 | 255 | 289 | 372 | 492 | 571 | 675 | ||
| 硫代硫酸鉀 | K2S2O3 | 96 | 155 | 175 | 205 | 238 | 293 | 312 | ||||
| 鎢酸鉀 | K2WO4 | 51.5 | ||||||||||
| 三氯化金 | AuCl3 | 68 | ||||||||||
| 三碘化金 | AuI3 | 1.295×10 | ||||||||||
| 草酸金(V) | Au2(C2O4)5 | 0.258 |
鈧
| 物質 | 化學式 | 0°C | 10°C | 20°C | 30°C | 40°C | 50°C | 60°C | 70°C | 80°C | 90°C | 100°C |
| 草酸鈧 | Sc2(C2O4)3·6H2O | 6×10 | ||||||||||
| 硫酸鈧 | Sc2(SO4)3·5H2O | 54.6 |
鑭、鋰、硫、鑥、鋁
| 物質 | 化學式 | 0°C | 10°C | 20°C | 30°C | 40°C | 50°C | 60°C | 70°C | 80°C | 90°C | 100°C |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 乙酸鑭 | La(C2H3O2)3·H2O | 16.9 | ||||||||||
| 溴酸鑭 | La(BrO3)3 | 98 | 120 | 149 | 200 | |||||||
| 碘酸鑭 | La(IO3)3 | 4.575×10 | ||||||||||
| 鉬酸鑭 | La2(MoO4)3 | 2.473×10 | ||||||||||
| 硝酸鑭 | La(NO3)3 | 100 | 136 | 168 | 247 | |||||||
| 硒酸鑭 | La2(SeO4)3 | 50.5 | 45 | 45 | 45 | 45 | 18.5 | 5.4 | 2.2 | |||
| 硫酸鑭 | La2(SO4)3 | 3 | 2.72 | 2.33 | 1.9 | 1.67 | 1.26 | 0.91 | 0.79 | 0.68 | ||
| 鎢酸鑭 | La2(WO4)3·3H2O | 6.06 | ||||||||||
| 乙酸鋰 | LiC2H3O2 | 31.2 | 35.1 | 40.8 | 50.6 | 68.6 | ||||||
| 疊氮化鋰 | LiN3 | 61.3 | 64.2 | 67.2 | 71.2 | 75.4 | 86.6 | 100 | ||||
| 苯甲酸鋰 | LiC7H5O2 | 38.9 | 41.6 | 44.7 | 53.8 | |||||||
| 溴酸鋰 | LiBrO3 | 154 | 166 | 179 | 198 | 221 | 269 | 308 | 329 | 355 | ||
| 溴化鋰 | LiBr | 143 | 147 | 160 | 183 | 211 | 223 | 245 | 266 | |||
| 碳酸鋰 | Li2CO3 | 1.54 | 1.43 | 1.33 | 1.26 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 | ||
| 氯酸鋰 | LiClO3 | 241 | 283 | 372 | 488 | 604 | 777 | |||||
| 氯化鋰 | LiCl | 69.2 | 74.5 | 83.5 | 86.2 | 89.8 | 98.4 | 112 | 121 | 128 | ||
| 鉻酸鋰 | Li2CrO4.2H2O | 142 | ||||||||||
| 重鉻酸鋰 | Li2Cr2O7.2H2O | 151 | ||||||||||
| 磷酸二氫鋰 | LiH2PO4 | 126 | ||||||||||
| 氟化鋰 | LiF | 0.16 | ||||||||||
| 氟硅酸鋰 | Li2SiF6.2H2O | 73 | ||||||||||
| 甲酸鋰 | LiHCO2 | 32.3 | 35.7 | 39.3 | 44.1 | 49.5 | 64.7 | 92.7 | 116 | 138 | ||
| 亞磷酸氫鋰 | Li2HPO3 | 4.43 | 9.97 | 7.61 | 7.11 | 6.03 | ||||||
| 氫氧化鋰 | LiOH | 12.7 | 12.7 | 12.8 | 12.9 | 13.0 | 13.3 | 13.8 | 15.3 | 17.5 | ||
| 碘化鋰 | LiI | 151 | 157 | 165 | 171 | 179 | 202 | 435 | 440 | 481 | ||
| 鉬酸鋰 | Li2MoO4 | 82.6 | 79.5 | 79.5 | 78 | 73.9 | ||||||
| 硝酸鋰 | LiNO3 | 53.4 | 60.8 | 70.1 | 138 | 152 | 175 | |||||
| 亞硝酸鋰 | LiNO2 | 70.9 | 82.5 | 96.8 | 114 | 133 | 177 | 233 | 272 | 324 | ||
| 草酸鋰 | Li2C2O4 | 8 | ||||||||||
| 高氯酸鋰 | LiClO4 | 42.7 | 49 | 56.1 | 63.6 | 72.3 | 92.3 | 128 | 151 | |||
| 高錳酸鋰 | LiMnO4 | 71.4 | ||||||||||
| 磷酸鋰 | Li3PO4 | 3.821×10 | ||||||||||
| 硒化鋰 | Li2Se | 57.7 | ||||||||||
| 亞硒酸鋰 | Li2SeO3 | 25 | 23.3 | 21.5 | 19.6 | 17.9 | 14.7 | 11.9 | 11.1 | 9.9 | ||
| 硫酸鋰 | Li2SO4 | 36.1 | 35.5 | 34.8 | 34.2 | 33.7 | 32.6 | 31.4 | 30.9 | |||
| 酒石酸鋰 | Li2C4H4O6 | 42 | 31.8 | 27.1 | 26.6 | 27.2 | 29.5 | |||||
| 硫氰酸鋰 | LiSCN | 114 | 131 | 153 | ||||||||
| 釩酸鋰 | LiVO3 | 2.5 | 4.82 | 6.28 | 4.38 | 2.67 | ||||||
| 二氧化硫 | SO2 | 9.4 | ||||||||||
| 氫氧化鑥(III) | Lu(OH)3 | 1.164×10 | ||||||||||
| 硫酸鑥(III) | Lu2(SO4)3·8H2O | 57.9 | ||||||||||
| 氯化鋁 | AlCl3 | 43.9 | 44.9 | 45.8 | 46.6 | 47.3 | 48.1 | 48.6 | 49 | |||
| 氟化鋁 | AlF3 | 0.56 | 0.56 | 0.67 | 0.78 | 0.91 | 1.1 | 1.32 | 1.72 | |||
| 硝酸鋁 | Al(NO3)3 | 60 | 66.7 | 73.9 | 81.8 | 88.7 | 106 | 132 | 153 | 160 | ||
| 高氯酸鋁 | Al(ClO4)3 | 122 | 128 | 133 | ||||||||
| 硫酸鋁 | Al2(SO4)3 | 31.2 | 33.5 | 36.4 | 40.4 | 45.8 | 59.2 | 73 | 80.8 | 89 | ||
| 氫氧化鋁 | Al(OH)3 | 0.0001 |