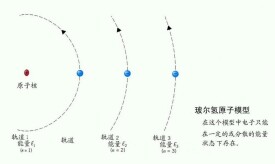
玻爾原子理論
1913年玻爾提出的物理理論
N.玻爾首創的第一個將量子概念應用於原子現象的理論。1911年E.盧瑟福提出原子核式模型,這一模型與經典物理理論之間存在著尖銳矛盾,原子將不斷輻射能量而不可能穩定存在;原子發射連續譜,而不是實際上的離散譜線。玻爾著眼於原子的穩定性,吸取了M.普朗克、A. 愛因斯坦的量子概念,於1913年考慮氫原子中電子圓形軌道運動,提出原子結構的玻爾理論。
理論的三條基本假設是
玻爾原子理論
電子繞核運動,其軌道半徑不是任意的,只有電子在軌道上的角動量滿足下列條件的軌道才是可能的:mvr=nh/(2π) (n=1,2,3…)式中的n是正整數,稱為量子數;式中h為普朗克常數,其約值為6.62607755x10的負34次方,單位是J`S。

尼爾斯·玻爾
設電子處於第n條軌道,軌道半徑為(rn),根據玻爾理論的軌道量子化得
m(vn)(rn)=mvr=nh/(2π) (n=1,2,3…)①
m(vn)^2/(rn)=1/(4πε0)*[e^2/(rn)^2]②
由①②式可得(rn)=ε0h^2*n^2/(πme^2) (n=1,2,3…)
當n=1時,第一條軌道半徑為r1=ε0h^2/(πme^2) =5.3*10^-11(m),其他可能的軌道半徑為(rn)=r1,4r1,9r1,25r1…
⑵氫原子的能級
當電子在第n條軌道上運動時,原子系統的總能量E叫做第n條軌道的能級,其數值等於電子繞核轉動時的動能和電子與原子的電勢能的代數和
En=1/2*m*(vn)^2-e^2/(4πε0(rn))③
由②式得1/2*m*(vn)^2=e^2/(8πε0(rn))④
將④式代入③式得En=-me^4/(8(ε0)^2h^2n^2)⑤
這就是氫原子的能級公式
當n=1時,第一條軌道的能級為E1==-me^4/(8(ε0)^2h^2)=-13.6eV.其他可能軌道的能級為En=E1/n^2=-13.6/n^2(eV)(n=2,3,4…)
由軌道半徑的表達式可以看出,量子數n越大,軌道的半徑越大,能級越高.n=1時能級最低,這時原子所處的狀態稱為基態,n=2,3,4,5…時原子所處的狀態稱為激發態。
⑶玻爾理論對氫光譜的解釋
由玻爾理論可知,氫原子中的電子從較高能級(設其量子數為n)向較低能級(設其量子數為m)躍遷時,它向外輻射的光子能量為hν=En-Em=-me^4/(8(ε0)^2h^2)(1/n^2-1/m^2)
由於c=λν,上式可化為1/λ=me^4/(8(ε0)^2h^2)(1/m^2-1/n^2)
將上式和里德伯公式作比較得R=me^4/(8(ε0)^2h^3c)=1.097373*10^7m^(-1)
這個數據和實驗所得的數據1.0967758*10^7m^(-1)基本一致,因此用玻爾理論能較好的解釋氫原子的光譜規律,包括氫原子的各種譜線系。例如:賴曼系、巴爾末系、帕邢系、布喇開系等的規律。