T細胞受體
固定在細胞膜上的異源二聚體
即T細胞抗原受體(T cell receptor,TCR):是T細胞特異性識別和結合抗原肽-MHC分子的分子結構,通常與CD3分子呈複合物形式存在於T細胞表面。大多數T細胞的TCR由α和β肽鏈組成,少數T細胞的TCR由γ和δ肽鏈組成。
T細胞受體(T cell receptor,TCR)是T細胞表面的特異性受體,負責識別由主要組織相容性複合體(MHC)所呈遞的抗原,與B細胞受體不同,並不能識別遊離的抗原。通常情況下,T細胞受體與抗原間擁有較低的親和力,因而同一抗原可能被不同的T細胞受體所識別,某一受體也可能識別許多種抗原。
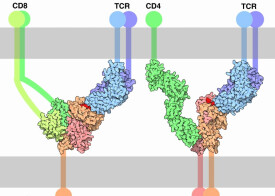
T細胞受體是一個固定在細胞膜上的異源二聚體,多數由高度易變的α亞基和β亞基通過二硫鍵連結構成。這一類T細胞被稱為αβ T細胞。少數含有γ亞基和δ亞基被稱為γδ T細胞。T細胞受體會與恆定的CD3分子一起構成T細胞受體複合體。
每一個亞基都含有兩個細胞外的結構域:可變區與恆定區。這些結構域屬於免疫球蛋白超家族,由反向平行的β摺疊所構成。恆定區靠近細胞膜,連接著跨膜區和胞內的末端,而可變區負責識別多肽/MHC複合體。每個亞基的可變區都包含三個高度易變的互補決定區(complementarity determining regions, CDR)。最重要的CDR3負責直接與MHC所呈遞的多肽結合。α亞基和β亞基的CDR1分別作用與多肽的N端和C端。CDR2被認為參與識別MHC。β亞基還有一個額外的CDR4,通常並不參與多肽/MHC複合體的識別,但與超抗原的作用有關。
更多資料:V(D)J重組。
T細胞受體的抗原結合位極為多樣化,產生這種多樣性的機理與B細胞受體和抗體多樣性的機理極為類似,主要源於免疫球蛋白基因的V(D)J重組。編碼免疫球蛋白的基因位點由許多基因片段構成,包括可變段(V)、連接段(J)以及之間可能存在的多樣段(D)。α和γ亞基由VJ重組產生,β和δ亞基則由VDJ重組產生。不同基因片段之間的隨機重組以及重組過程中隨機插入的核苷酸極大地豐富了T細胞受體的多樣性。
每個T細胞都會在細胞表面表達大量單一種類的受體。在生理環境下,T細胞受體和與之對應的多肽/MHC複合體間有著很高的結合速率和分離速率。T細胞受體對於某一種或一些抗原有高度的特異性,但單一受體的親和力較低,大約在微摩爾的水平。另外,目標細胞表面有大量的MHC複合體,但與某一T細胞對應的複合體數量極低。儘管如此,T細胞對特異抗原的識別以及反應相當靈敏和高效。這種高效源於T細胞受體在識別過程中寡聚化,在細胞表面形成微簇,提高了T細胞對抗原的親合力(en:avidity)。因此,能與T細胞受體多價結合的分子(比如CD3抗體)可以像MHC複合體一樣高效地激活T細胞,雖然它們並不作用於受體的抗原結合區。通常被抗原激活過的T細胞的靈敏度高於未分化的T細胞。實驗表明,較之激活后的輔助型T細胞和記憶T細胞,未分化的T細胞的活性更依賴高濃度的抗原以及各種輔助刺激因子。據此,原始T細胞在分化過程中會經歷親合力成熟的過程,而T細胞受體的親和力並不改變。
T細胞受體複合體是一個跨膜的八聚體,由TCR二聚體和負責信號傳遞的CD3 δ/ε二聚體、CD3 γ/ε二聚體以及CD247 ζ/ζ或是ζ/η二聚體構成。各個二聚體通過電離的氨基酸殘基間的相互作用聯繫在一起。T細胞受體的胞內末端很短,極有可能並不參與信號的傳遞。整個複合體可以高效地將受體接受到的信號傳遞到細胞內。
T細胞受體與特異抗原的結合需要協同受體同時結合到MHC分子上加以強化。總共有兩種不同的T細胞協同受體:
• 輔助型T細胞表面的CD4分子,負責識別第二類主要組織相容性複合體(MHC II)
• 細胞毒性T細胞表面的CD8分子,負責識別第一類主要組織相容性複合體(MHC I)
協同受體不僅提高了T細胞受體在功能上的特異性,而且延長了T細胞與抗原呈遞細胞的作用時間,還是細胞內信號通路的一些分子(如Lck)的附著點。
T細胞受體的主要功能是在識別特異抗原后激活T細胞。T細胞激活的過程屬於跨膜信號傳遞,由眾多的分子和生化反應共同完成。細胞內信號傳遞最常見的方式是由激酶和磷酸酶所主導的蛋白磷酸化和去磷酸化。CD3和ζ亞基的胞內區域有許多免疫受體酪氨酸激活基序(en:immunoreceptor tyrosine-based activation motifs, ITAM)。在T細胞受體被激活后,這些序列中的酪氨酸被Src激酶家族磷酸化,從而實現了信號的跨膜傳遞。
早期的胞內信號傳遞由下列的激酶和磷酸酶共同完成:
• Lck:Src激酶家族,結合在CD4的胞內末端,負責ITAM的磷酸化
• Fyn:Src激酶家族,與Lck類似,負責CD3和ζ亞基上ITAM的磷酸化
• CD45:胞內末端是酪氨酸磷酸酶,負責Src激酶家族上抑制性酪氨酸的去磷酸化,從而激活Src激酶
• ZAP70:Syk激酶家族,通過SH2結構域結合在磷酸化的ITAM上,負責LAT的磷酸化