能量均分定理
一種聯繫系統溫度及其平均能量的基本公式
在徠經典統計力學中,能量均分定理(Equipartition Theorem)是一種聯繫系統溫度及其平均能量的基本公式。能量均分定理又被稱作能量均分定律、能量均分原理、能量均分,或僅稱均分.
能量均分的初始概念是熱平衡時能量被等量分到各種形式的運動中;例如,一個分子在平移運動時的平均動能應等於其做旋轉運動時的平均動能。
能量均分定理能夠作出定量預測。類似於均功定理,對於一個給定溫度的系統,利用均分定理,可以計算出系統的總平均動能及勢能,從而得出系統的熱容。均分定理還能分別給出能量各個組分的平均值,如某特定粒子的動能又或是一個彈簧的勢能。例如,它預測出在熱平衡時理想氣體中的每個粒子平均動能皆為(3/2)kT,其中k為玻爾茲曼常數而T為溫度。更普遍地,無論多複雜也好,它都能被應用於任何處於熱平衡的經典系統中。能量均分定理可用於推導經典理想氣體定律,以及固體比熱的杜隆-珀蒂定律。它亦能夠應用於預測恆星的性質,因為即使考慮相對論效應的影響,該定理依然成立。
儘管均分定理在一定條件下能夠對物理現象提供非常準確的預測,但是當量子效應變得顯著時(如在足夠低的溫度條件下),基於這一定理的預測就變得不準確。具體來說,當熱能kT比特定自由度下的量子能級間隔要小的時候,該自由度下的平均能量及熱容比均分定理預測的值要小。當熱能比能級間隔小得多時,這樣的一個自由度就說成是被“凍結”了。比方說,在低溫時很多種類的運動都被凍結,因此固體在低溫時的熱容會下降,而不像均分定理原測的一般保持恆定。對十九世紀的物理學家而言,這種熱容下降現象是表明經典物理學不再正確,而需要新的物理學的第一個徵兆。均分定理在預測電磁波的失敗(被稱為“紫外災變”)導致普朗克提出了光本身被量子化而成為光子,而這一革命性的理論對刺激量子力學及量子場論的發展起到了重要作用。
參見:動能和理想氣體
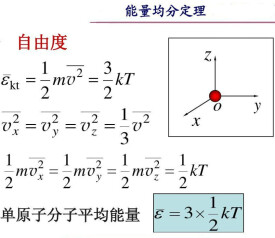
應用波爾茲曼統計方法可以得到:氣體處於平衡態時,分子任何一個自由度的平均能量都相等,均為kT/2,這就是能量按自由度均分定理,簡稱能量均分定理。名字裡面的“均分”是指“攤分或類似於攤分”。能量均分定理的原始概念是,當系統達到熱平衡時,系統的總動能由各獨立分量所等分。均分定理也為這些能量做出量化的預測。例如它預測惰性氣體的每一個原子,當於溫度T達至熱平衡時,會有平移平均動能(3/2)KT,其中K為玻爾茲曼常數。隨此引出的是,在等溫時氙的重原子速度會比氦的較輕原子要低。圖二顯示的是四種惰性氣體原子速度的麥克斯韋-玻爾茲曼分佈。
在這例子中,關鍵點是動能是速度的二次齊函數。均分定理顯示出於熱平衡時,任何在能量中只以二次出現的自由度(例如是一粒子的位置或速度的一個分量)有著等於½KT的平均能量,並因此向系統的熱容提供了½K。這個結果有著許多的應用。
均分定理的一個重要應用是在於晶狀固體的比熱容。如此固體的每一個原子都能夠在三個獨立的方向下振蕩,因此該固體可以被視為一個擁有各自獨立的3N個簡諧振子的系統,其中N為晶格中的原子數。由於每一個諧振子都有平均能量kT,所以固體的平均總能量為3NkT,而比熱容則為3Nk。如取N為阿伏伽德羅常數N,並使用R = Nk這個聯繫氣體常數R及玻爾茲曼常數k的關係式,可得固體摩爾比熱容的杜隆-珀蒂定律的一個解釋,定律指出晶格中每摩爾的原子熱容為3R≈ 6cal/(mol·K)。
然而,由於量子效應的關係,這條定律在低溫時並不準確;這也不符合實驗導出的熱力學第三定律,第三定律指出摩爾比熱容於絕對零度時必為零。艾爾伯特·愛因斯坦(1907年)及彼得·德拜(1911年)在基礎上加入了量子效應,發展出一套更準確的理論。
固體中每個原子的振動不是獨立的,可以用一組組的耦合振子作為模型。如此振蕩子的模型可以被分解成簡振模,這跟鋼琴弦的振動模態及管風琴的共振模態是相近的。另一方面,均分定理被應用於這種系統時一般都會失敗,因為正常模態間是沒有能量交換的。在一個非常的情況下,模態獨立且它們的能量獨立地守恆。這個顯示出有某種的能量混合,正式叫做遍歷性,對於均分定理的成立是十分重要的。
動能均分這個概念最早是在1843年,或更準確地說應是1845年,由約翰·詹姆斯·瓦塔斯頓提出的。於1859年,詹姆斯·克拉克·麥克斯韋主張氣體的動熱能由線性及旋轉能量所等量攤分於1876年,路德維希·玻爾茲曼因表明了平均能量是被一系統中各獨立分量所等分,而將原理進一步擴展。玻爾茲曼亦應用了均分定理去為固體比熱容的杜隆-珀蒂定律提出了一個理論解釋。
能量均分定理的歷史與摩爾比熱容的歷史是密不可分的,兩者都是在十九世紀時被研究的。於1819年,法國物理學家皮埃爾·路易斯·杜隆與阿勒克西斯·泰雷塞·珀蒂發現了所有室溫下的固體比熱容幾乎都是相等的,約為6cal/(mol·K)。他們的定律曾在多年間被用作量度原子質量的一種技巧,然而,後來詹姆斯·杜瓦及海因里希·夫里德里希·韋伯的研究表明杜隆-珀蒂定律只於高溫時成立;在低溫時或像金剛石這種異常地硬的固體,比熱還要再低一點。
氣體比熱的實驗觀測也引起了對均分定理是否有效的質疑。定理預測簡單單原子氣體的摩爾比熱容應約為3cal/(mol·K),而雙原子氣體則約為7cal/(mol·K)。實驗驗證了預測的前者,但卻發現雙原子氣體的典型摩爾比熱容約為5cal/(mol·K),並於低溫時下跌到約3cal/(mol·K)。詹姆斯·克拉克·麥克斯韋於1875年指出實驗與均分定理的不合比這些數字暗示的要壞得多;由於原子有內部部分,熱能應該走向這些內部部分的運動,使得單原子及雙原子的比熱預測值比3cal/(mol·K)7cal/(mol·K)要高得多。
第三個有關的不符之處是金屬的比熱。根據經典德魯德模型,金屬電子的舉止跟幾乎理想的氣體一樣,因此它們應該向(3/2)Nk的熱容,其中N為電子的數量。不過實驗指出電子對熱容的供給並不多:很多的金屬的摩爾比熱容與絕緣體幾乎一樣。
數個說明均分失敗原因的解釋被提出了。玻爾茲曼辯護他的均分定理推導是正確的,但就提出氣體可能因為與以太相互作用而不處於熱平衡狀態。由於與實驗不符,開爾文勛爵提出均分定理的推導一定是不定確的,但卻說不出什麼不正確。反而瑞利勛爵提出一個更徹底的看法,說均分定理及實驗時系統處於熱平衡的假設這兩者都正確;為使兩者相符,他指出需要一個能為均分定理提供“從破壞性的簡單中逃走的去路”的新原理。艾爾伯特·愛因斯坦就提供了這條去路,於1907年他表明了這些比熱的異數都是由量子效應引起的,尤其是固體彈性模態能量的量子化。愛因斯坦用了均分定理的失敗作為需要一個新物質量子理論的論據。瓦爾特·能斯特於1910年在低溫的比熱量度支持了愛因斯坦的理論,並引起了物理學家們對量子理論的廣泛承認。
參見:遍歷性、混沌理論和柯爾莫哥洛夫 - 阿諾德 - 莫澤定理
均分定律只對處於熱平衡的遍歷系統有效,這意味著同一能量的態被遷移的可能性必然一樣。故此,系統一定要可以讓它所有各形態的能量能夠互相交換,或在正則系綜中跟一熱庫一起。已被證明為遍歷的系統數量不多;雅科夫·西奈的硬球系統是一個有名的例子。讓隔離系統保證其遍歷性——因而,均分定理——的需求已被研究過,同時研究還推動了動力系統混沌理論的發展。一混沌哈密頓系統不一定是遍歷系統,儘管假定它是通常也足夠準確。
有時候能量並不由它的各種形式所攤分,且此時均分定理在微正則系綜不成立,耦合諧波振蕩器系統就是在這狀況下常被引用的一個例子。如果系統跟外界隔絕,那每一個正常模態的能量是恆定的;能量並不由一個模態傳遞到另一模態的。因此在這樣一個系統中均分定理無效;每一個模態能量的量都被它的起始值所固定。如果能量函數中有著足夠強的非線性量的時候,能量可能可以在正常模態中傳遞,使系統走向遍歷並使均分定律有效。然而,柯爾莫哥洛夫 - 阿諾德 - 莫澤定理明確指出除非擾動夠強,否則能量不會交換;如擾動小的話,最低限度能量會繼續受困於一些模態中。
參見:紫外災變、量子力學史和全同粒子
當熱能kT比能級間的差要小得多的時候,均分法則就會失效。均分此時不再成立,是因為能級組成平滑連續能譜的這個假設跟實際情況不近似,而這假設在上面均分定理推導中有用到。歷史上,經典均分定理在解釋比熱及黑體輻射時的失敗,對表明需要一套物質及輻射的新理論(即量子力學及量子場論)起了關鍵性的作用。
• 均功定理
• 分子運動論
徠• 統計力學
• 量子統計力學