若總包反應由一系列快慢懸殊的連續步驟組成,總反應速率就決定於其中最慢的一步,即控制步驟。液相反應中,溶劑籠(見籠效應)中的反應物分子必須通過擴散擠過溶劑分子,與其他反應物分子在另一籠中形成偶遇對(見分子偶遇),再經多次碰撞才能生成產物;產物也必須通過擴散擠過溶劑分子后才能彼此分開。因此,液相中還存在有擴散步驟,如果它最慢,反應就受擴散步驟控制。此時,無須算出總碰撞數,只要求出第一次偶遇的數目,就能確定雙分子反應的最大速率。這些偶遇取決於粘滯介質中的混亂運動,因而它是受擴散控制的。
擴散控制
化學反應速率由擴散來控制的現象。化學反應太快時,擴散來不及供給反應以足夠的分子,所以產生反應由擴散來控制的現象。液相反應可寫成:式中k為
反應速率常數。總反應速率R=kr【A…B】。經
穩態近似處理得:k=kdkr/(kd+kr)。當反應速率遠大於偶遇對離解速率,即kr》k-d時,則A和B一經擴散生成偶遇對【A…B】,立即反應成產物。k=kd,總反應速率由
擴散速率kd決定,A和B的擴散成為控制性的。為了求出kd,須計算擴散速率,即B分子流向單個A分子的通量J(J=4πrABDAB【B】,它是單位時間內物質通過以A為中心的球面的量)乘以A的濃度:R=J【A】式中rAB為A和B分子相互作用距離;DAB=DA+DB為相對擴散係數。如將典型值DAB=2×10-9米2/秒,rAB=0.5納米代入,可求出k≈8×109分米3/(摩爾·秒)。當速率高於或等於擴散速度上限〔k≥109分米3/(摩爾·秒)〕時,表示反應速率比擴散速率高,受擴散控制,否則就受反應本身的活化控制。

擴散控制
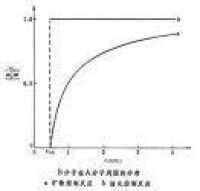
擴散控制是由於化學反應太快,擴散來不及供給反應以足夠的分子所致。從分子尺寸的角度看,它的特點是,B分子在A分子周圍形成
濃度梯度(圖中曲線a),而活化控制未建立起濃度梯度(曲線 b)。擴散控制反應的指前因子比氣相中的稍大,
活化能卻要小很多,一般估計為21千焦/摩爾。由於液相中分子的運動有賴於各種分子(包括溶劑分子)的聯合運動,活化能是有關因素的總結果,其來源比氣相反應複雜,不能簡單地稱之為擴散活化能。此外,擴散控制的反應速率與擴散係數有關,斯托克斯-愛因斯坦方程把擴散係數與溶劑的粘度聯繫起來,而粘度是受溫度影響的。因此在溫度高、粘度小而擴散係數大的溶劑中,擴散控制反應速率高,否則相反。

擴散控制
①
酸鹼反應,如
H++OH-─→H2O,298K時, k=1.4×1011分米3/(摩爾·秒);
②
原子和
自由基複合反應,氣相中活化能為零,298K時碘原子在
己烷溶劑中複合的k=1.3×1010分米3/(摩爾·秒);
③電子激發態分子的猝滅, 如萘(S1)+聯乙醯─→萘+聯乙醯(S1), k=2.2×1010分米3/(摩爾·秒)。此外還有溶劑化電子和
陽離子之間的擴散控制反應等。