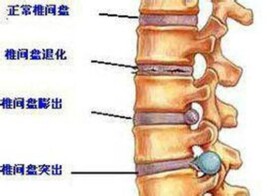
腰椎間盤退變
腰椎間盤退變
下腰痛和急性下肢神經根性疼痛是腰椎間盤退變與突出等椎間盤疾患的主要癥狀,其發生的具體原理還未完全明確。
目錄
1934年Mixter等開始直觀地認為,突出的腰椎間盤進入硬膜腔后,直接壓迫並刺激神經根,是引發坐骨神經痛等癥狀的基礎。從此,機械性壓迫一直是被公認的原因。但研究發現,機械性致痛原理並不能完全囊括該病變的病理生理變化。
1 對單一機械致痛理論的置疑
臨床發現,一些患者雖然具有較大的椎間盤突出,卻沒有明顯的神經根性癥狀;有的患者椎間盤突出範圍小,神經根性癥狀卻異常顯著,甚至比大面積的椎間盤突出癥狀更強烈;還有的患者髓核等結構並無多大變化,但卻有明顯的下肢痛、感覺異常等神經病變表現。這些現象提示,腰椎間盤突出后神經根的受壓程度與病人的臨床癥狀並不呈正相關;同時手術也觀察到,對於神經根有充血水腫等炎症改變、觸之較敏感的患者,其神經性疼痛的表現也較劇烈。這些都提示神經根性疼痛與局部炎症似乎有一種密切的關係。
2 炎症因素在腰椎病變中的發現與作用
對於上述現象的解釋,可以從生化和機械兩種因素入手。可以斷定,椎間盤退變與突出過程中的炎症因素包含於機械因素中而起作用,產生腰背痛及下肢神經癥狀,這樣同時也就能夠解釋為何皮質類固醇激素等藥物對該類疾病有一定的治療作用。
目前,雖然尚不能完全確定髓核組織中具體是那一類組織成分或是化學因子導致炎症反應,但普遍認為磷脂酶A2(phospholipase,PLA2)的存在及其活性的改變是重要的因素[3,4]。
3 椎間盤中的炎症調節因子
在沒有免疫反應的情況下,生物化學因子對炎症的啟動是腰椎間盤退變和突出致痛的重要機制,在人體和動物體內已發現的炎症因子有以下幾種。
3.1 PLA2 PLA2是體內重要的炎症介質,Saal等於1990年測定了5 例人體突出的椎間盤內PLA2的活性,發現其高於正常20~10 000倍;Franson等將人體椎間盤中提取的PLA2應用於動物模型中顯示了其致炎的特性。隨後,許多作者採用直接或間接的實驗方法都證實了此觀點。
關於椎間盤中PLA2活性增高與退變和突出的關係,目前認為PLA2作為一種化學炎症介質,在人體內受到內源性抑制物和促進物(例如PLA2激活蛋白)的調控,一旦這種平衡被迫壞,便可激活它。椎間盤內PLA2的激活可能與退變有關,因為椎間盤退變必定涉及生物化學平衡的改變。可以推斷,PLA2聚集在椎間盤內是老化和退變的結果,而上述每一個進展性的生化改變,在理論上促進了椎間盤內PLA2的激活。
關於PLA2與椎間盤源性下腰痛的關係,目前尚不明確。椎間盤退變包括生化平衡的改變,其中PLA2活性和數量的改變就是這一失衡的體現,失去對這一具有潛在致炎能力酶的調節與控制,是激發和促進椎間盤退變的重要因素。
椎間盤源性疼痛是臨床上常見的癥狀,該類患者大都沒有明顯的神經壓迫,但卻有下腰痛,伴或不伴下肢痛。此類神經根性疼痛往往呈燒灼樣,而且與機械負荷無關。炎症的直接作用可以解釋其發病機理,因為炎症可以導致髓核或椎間盤周圍感受神經致敏,神經節受到刺激后,即使周圍組織處在生理狀態下,也會出現下腰痛或下肢根性疼痛。當這種情況發生后,侵襲性治療是非常必要的,用以阻止和治療慢性腰痛綜合征。
3.2 細胞因子 Tskahashi對77 例椎間盤突出並伴有顯著的神經根性癥狀患者的椎間盤組織應用生化和免疫組化方法分析,發現了多種白細胞介素(IL1α,IL1β,IL6)及腫瘤壞死因子α(tumor necrosing factor α,TNFα);Kang等培養突出的椎間盤組織,與正常對照組比較,具有高水平的IL6。IL1α與TNFα能夠誘導組織細胞產生前列腺素E2(prostaglaudin E2,PGE2),引起肢體的感覺過敏並進而誘導產生致痛物質緩激肽,從而產生坐骨神經痛。近來的研究表明,TNFα的產生可能啟動一個引起其他細胞因子釋放的級聯反應,並證實TNFα還與椎間盤的退變、吸收等過程有關。
3.3 PGE2 Kang等對15 例椎間盤突出伴持續根性癥狀患者的椎間盤進行了分析,發現大量PGE2的存在;Takahashi等的研究也得出了同樣的結論。前列腺素是重要的炎症調節因子,可引起組織的炎症損害,並且是重要的致痛因素,其機理可能是降低傷害感受器的閾值並刺激C類神經纖維。另外它可以提高其他致痛物質的敏感性,從而加強致痛作用。
3.4 一氧化氮 Kang等通過對15 例椎間盤突出伴有下肢根性癥狀患者椎間盤的體外培養,發現突出的椎間盤組織中一氧化氮含量顯著高於正常對照組。一氧化氮作為一個炎症前因素,可導致血管舒張和血管通透性升高。同時,一氧化氮還具有抗炎症的作用,因為它能夠抑制PGE2、血栓素和IL6的合成。
3.5 免疫球蛋白 目前至少有三篇文獻報導了免疫球蛋白在椎間盤組織中的沉積。IgG在狗的椎間盤中被發現,IgM則與椎間盤的炎症與坐骨神經痛的發生有關。Habtemariam等通過屍體解剖,獲取了52 例肉眼觀察無異常的人體椎間盤,應用免疫組化技術,對其均應用同樣的單克隆抗IgG與IgM抗體的免疫細胞化學技術。結果發現,52 例椎間盤中29 例有IgM的沉積,18 例出現IgG,正常對照組中沒有任何免疫球蛋白的出現,進一步實證了上述實驗結果。免疫球蛋白都出現在血管的周圍,因此可以認為它們可能是直接抗椎間盤組織的抗體。
3.6 其他的調節因子 通過對椎間盤組織的免疫組織學分析,浸入脫出的椎間盤組織中的單核細胞和內皮細胞有抗細胞黏連分子1(icam1或CD54)的表達。ICAM1在細胞表面受到細胞因子如IL1、TNFα和γ干擾素的調節。對ICAM1的調節可以加強白細胞等炎症細胞的吸附,促進它們向炎症區域的遊走。這些黏附分子對炎症的產生和免疫細胞遊走的調節至關重要。另外,通過與ICAM1結合併參與細胞間黏連的抗淋巴細胞功能相關抗原1,有時也在一些樣本周圍的單核細胞中表達。
4 針對腰椎間盤退變與突出的藥物治療
許多作者依據炎症機制導致神經根損傷這一理論,應用皮質類固醇激素降低PLA2的炎症效應,取得良好的療效。而且,激素可抑制由髓核內糖蛋白引起的自主免疫反應,阻止淋巴細胞、單核細胞和巨噬細胞產生細胞因子。
Kawakami等證明麥帕克林(mepacrine)可抑制椎間盤中PLA2對坐骨神經的痛覺致敏,但由於強烈的胃腸道反應和中樞神經系統毒性反應,限制了其應用。
類固醇激素是另一類能有效控制PLA2活性的藥物,它通過阻止粒細胞以及巨噬細胞的脫顆粒作用,並能抑制巨噬細胞抑制因子,穩定溶酶體膜和其他細胞膜而發揮作用,對控制PLA2活性有效。Franson等報導了順式不飽和脂肪酸的氧化反應在體內和體外對PLA2的有效抑制作用。另外,已被證實的PLA2抑製劑還有manoalide,manoalogue,phromophenacylbromine等,但這些化合物對PLA2的抑制缺乏特異性,且有一定的毒性作用。
5 椎間融合技術的應用
應用腰椎前路融合術是目前治療椎間盤源性疾病的有效手段,腹腔鏡等微創手術的進展為這一治療方式開闢了新的空間。Muschik等將純化的骨形態發生蛋白2直接注入到兔的腰椎內,觀察發現注射劑量為150 mg的一組,椎間形成明顯的骨橋,達到了融合的效果,從而為利用微創技術椎間盤內注射骨形態發生蛋白(bone morphogenetic protein,BMP)行腰椎前路融合打下了實驗基礎。而且經研究證實,BMP、轉化生長因子β和鹼性成纖維細胞生長因子在體內誘導成骨中具有協同作用,BMP在脊柱融合術中的作用日益得到肯定。張益民等通過動物實驗,直接將BMP注射到兔的腰椎間盤髓核內,證實了BMP在促進腰椎融合的同時,對PLA2這一炎症因子的抑制作用。
在臨床應用方面,包括一些保守療法(如麥肯基療法),均是基於脊柱的機械力學原理。椎間盤源性椎體失穩是椎體前路融合術的絕對適應證。椎間盤退變時PLA2活性升高,可採取椎間盤內注射PLA2抑製藥物。
6 展 望
椎間盤退變、椎體失穩和椎間盤內PLA2活性升高三者間是互為因果、相互促進的關係。關於其治療,可以設想若椎間盤內注射的藥物既能達到融合穩定脊柱,又能降低PLA2活性則是理想的治療方法。傳統的PLA2活性抑製劑(如類固醇激素、阿的平等)不同時具備這兩種功能,因而在椎間隙內注射促融合藥物(如BMP)的同時,測定其對PLA2活性的影響非常必要,以期達到一舉兩得的作用。