有限固溶體
有限固溶體
有限固溶體(limit solid solution)
溶質原子在溶劑中的溶解度有一定限度(這一限度稱為溶解度或固溶度),形成的固溶體為有限固溶體。固溶度範圍為大於0%而小於100%。例如,位於相圖端部的端際固溶體都是有限固溶體。
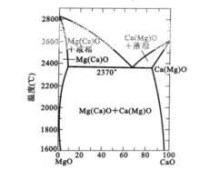
MgO-CaO系統有限固溶體
能以一定的限量溶入溶劑,超過這一限量即出現第二相。例如,MgO和CaO形成有限固溶體,如圖所示。在2000℃時,約有3%CaO(質量百分數)溶入MgO中,超過這個限量,便出現CaO固溶少量MgO的第二相。從相圖可以看出,溶質的溶解度隨溫度升高而增大。
下面講述的是液態完全互溶,固態部分互溶的二元系。這類體系的狀態圖有共晶型(或低共熔型)和轉熔型(或包晶型)兩類。
(1)共晶型的有限固溶體
下圖是這個體系的狀態圖,T、T分別是組分A、B的熔點。TE和TE線是液相線,與它們相對應的固相線是TF和TM。過兩液相線的交點E所作的三相等溫線FEM截兩固相線於F和M兩點,在此線上是E溶液和F、M兩種固溶體三相共存。所以F和N是一對互為飽和的共軛固溶體,線FG和MN就是這對固體的部分互溶曲線。
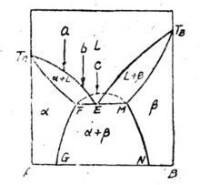
共晶型的有限固溶體
E(L)←→F(α)+ M(β)條件:冷卻
由於從冷卻方向看三相反應是從溶液中同時析出兩種固溶體,故稱此類體系為共晶型。
(2)轉熔型的有限固溶體
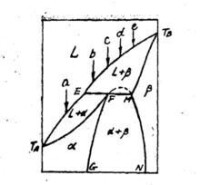
轉熔型的有限固溶體
和共晶型部份固溶體的相圖類似,這裡也有三個單相區(L,α,β);三個雙相區(L+ α,L+ β,α + β)和一根三相線。不同的只是在共晶型相圖中三相線的上方是兩個雙相區,下方是一個雙相區,但這裡的情形卻恰恰相反,這就決定了這裡的三相反應該是:
E(L)+M(β)←→F(α)條件:冷卻
從冷卻方向看是E溶液和M固溶體(屬於β晶型)作用以形成F固溶體(屬於α晶型)。這就是稱這類體系為轉熔型的原因(取M固溶體熔化井轉變為F固溶體之意)。
有限固溶體還有另一種結構——間隙固溶體。在間隙固溶體里,溶質原子是分佈在溶劑品格的間隙位置上。下圖是碳溶於α-Fe的示意圖。溶質原子溶到溶劑晶格間隙位置以後,要向外擠,迫使其周圍的溶劑原子離開自己的正常位置,產生品格畸變。可見,形成間隙固溶體時,將使晶格常數增大。溶質溶解的愈多,晶格畸變愈大。因此,間隙固溶體都是有限固溶體。
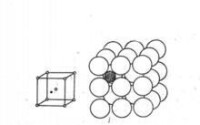
碳溶於α-Fe的示意圖
影響固溶體固溶度的主要因素如下:
(1)負電性因素。溶質原子與溶劑原子負電性相差越大,二者化學親合力越大,固溶度越小,甚至形成固溶體困難,易形成穩定化合物。
(2)原子尺寸因素。組元間原子半徑越相近即Ar越小,固溶體的固溶度越大,而Ar越大,晶格畸變能越高,固溶度則越低。
(3)晶體結構周素。兩組元的晶體結構相同時才能形成無限固溶體,或具有較大的固溶度,而晶體結構不同,固溶度則較小。
(4)電子濃度因素。溶質元素的價數越高,形成固溶體的固溶度越小。