解旋酶
解旋酶
解旋酶是一類解開氫鍵的酶,而不是一種酶,由水解ATP供給能量來解開DNA的酶。它們常常依賴於單鏈的存在,並能識別複製叉的單鏈結構。一般在DNA或RNA複製過程中起到催化雙鏈DNA或RNA解旋的作用。
與解鏈有關的酶和蛋白質包括:1.單鏈結合蛋白2.解旋酶 3.拓撲異構酶Ⅰ 4.拓撲異構酶Ⅱ。
在細菌中類似的解旋酶很多,都具有ATP酶的活性,大部分的移動方向是5'→3',但也有3'→5'移到的情況,如n'蛋白在φχ174以正鏈為模板合成複製形的過程中,就是按3'→5'移動。
DNA解旋酶(DNA helicase)
通常為流體蛋白環,通過ATP水解產生的能量由解旋酶裝載器裝載到DNA單鏈上(單鏈穿過環中央),有3‘--5’或5‘--3’方向極性,該極性就是它結合的單鏈的極性。它像DNA聚合酶一樣具有延伸性。
與解旋酶裝載器結合,裝載到單鏈DNA上之前,DNA解旋酶是沒有活性的,只有解旋酶裝載器將它裝載到單鏈DNA上,解旋酶裝載器自動離開之後,DNA解旋酶的活性才被激活。直到雙鏈全部解開,運動到單鏈末端時,它才從單鏈上離開。
注意DNA解旋酶結合的是DNA單鏈而不是雙鏈,至於它結合的單鏈,是由起始子蛋白作用到被稱為複製器的DNA區段使該區段發生雙鏈解旋才產生的。
DNA解旋酶作用於DNA雙鏈的氫鍵上。
下面有兩類觀點
1、不需要: DNA複製需要解旋酶,可是與DNA複製相類似的轉錄過程並不需要解旋酶,基因的轉錄是由RNA聚合酶催化進行的。基因的上游具有結合RNA聚合酶的區域,叫做啟動子。啟動子是一段具有特定序列的DNA,具有和RNA聚合酶特異性結合的位點,決定了基因轉錄的起始位點。RNA聚合酶與啟動子結合后,在特定區域將DNA雙螺旋兩條鏈之間的氫鍵斷開,使DNA解旋,形成單鏈區,以非編碼鏈為模板合成RNA互補鏈的過程就開始了。
參與典型的真核生物轉錄開始過程的轉錄因子TFII-H和TFII-F有ATPase活性幫助轉錄起始複合物“撬開”DNA雙鏈,但是TFII-H隨後表現磷酸化活性,使得RNA聚合酶II從通用轉錄因子上釋放,執行轉錄延伸階段。
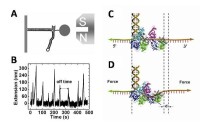
1、單分子動力學研究闡釋UvrD解旋酶的工作機理:
解旋酶是一種常見的馬達蛋白,它以核酸單鏈為軌道沿著核酸鏈定向移動,並利用ATP水解提供的能量打開互補的核酸雙鏈, 獲得單鏈。解旋酶在DNA的複製、修復、重組以及轉錄等代謝過程都起著重要作用。但是人們迄今還沒有完全理解解旋酶的解旋機制。單分子操縱技術幫助人們在單分子水平定量研究解旋酶的解旋動力學,是研究解旋酶分子機制的高端技術。大腸桿菌UvrD解旋酶是具有在DNA單鏈上由3′至 5′方向行走極性的解旋酶,有4個子功能域。關於UvrD各個子功能域的功能、它的解旋機制、特別是其有效的工作模式一直是爭論的焦點(Cell,127(2006)1349; Nat. Rev. Mol. Cell Biol. 9(2008)391)。
2、單分子熒光分析技術揭示解旋酶作用機制:
類似解旋酶的蛋白與核酸相互位置的轉變具有重要的細胞生物學意義,但是至今科學家們還並不清楚這個過程如何解開DNA結合蛋白,而且這一過程的基本特徵迄今為止仍然倍受爭議。 DNA修復指雙鏈DNA上的損傷得到修復的現象,這個過程可能使DNA結構恢復原樣,重新能執行它原來的功能,DNA修復是探索生命的一個重要方面,而且與遺傳疾病、腫瘤學等密切相關。對不同的DNA損傷,細胞可以有不同的修復反應。
DNA解鏈酶在DNA不連續複製過程中,結合於複製叉前面,催化DNA雙鏈結構解鏈,並具有ATP酶活性的酶,兩種活性相互偶聯,通過水解ATP提供解鏈的能量。不同來源的DNA解旋酶的共同特性是通過水解ATP提供解鏈的能量,而複製叉結構的存在與否對活性的影響因酶而異》
研究人員利用單分子熒光共振能量轉移技術(FRET)解析了這一過程,如下圖所示,這種PcrA螺旋酶通過2B位點結合在模板鏈上,沿著滯后鏈滑動,形成一個單鏈環,從而反覆的,統一步驟的完成功能。這個過程需要PcrA開放性的結構,能快速的替換RecA,這為分析DNA複製過程提供了一種新模型。
這個過程使用了兩種染料,這些染料熒光強度可根據它們之間的靠近距離發生改變。研究人員將兩種染料分別連接到單鏈DNA的兩個末端,從而能直接觀察到DNA鏈的作用方式,他們發現這兩種染料能相互靠近,然後又分開,這樣重複,其中PcrA並沒有沿著單鏈尾部移動,而是與DNA鏈斷裂端結合,拉動DNA使之與結合蛋白分離。當這一過程結束的時候,PcrA就會鬆開。
這裡運用到的單分子熒光技術實際上就是大家熟悉的單分子熒光共振能量轉移技術,這種技術是指當兩種不同的熒光生色團離的較近,且其中一種生色團(供體, donor)的發射譜與另一種生色團(受體, acceptor)的激發譜有相當程度的重疊時,當供體被激發時,受體會因供體激發能的轉移而被激發。其直觀表現就是供體產生的熒光強度較其單獨存在時要低的多,而受體發射的熒光卻大大增強,同時伴隨它們熒光壽命的相應縮短和延長。
這種技術是研究蛋白質相互作用比較成熟、已被廣泛應用的幾種方法之一,而用於DNA與蛋白之間的相互作用關係研究則是動態結構生物學研究領域關注的焦點。
用單分子熒光光譜技術研究生物分子構象變化的方法主要有兩種:一是通過單分子熒光偏 振 的 各 向 異 性( single molecule fluorescencepolarization anisotropy,smFPA)研究生物分子的構象動力學(conformational dynamics)和旋轉運動(rotational motions)。另一個是單分子對熒光共振能量轉移(single pair fluorescence resonance energytransfer, spFRET),在單分子水平測量一個分子內或兩個不同分子間的距離變化和相互作用。
在幾年前,Taekjip Ha教授研究組就利用這一方法研究分析了DNA解旋酶,他們用熒光染料做上了標記:給Rep(DNA解旋酶中作為引擎的那部分結構)加上了綠色熒光蛋白,給DNA鏈末端加上了紅色熒光蛋白,觀測一個熒光分子如何傳遞能量給另一個從而獲知被標記的分子相對於另一個被標記的分子是如何運動的。
研究人員發現當Rep靠近到DNA鏈末端阻隔時,這個酶並沒有停在那兒而是跳回到了DNA鏈的開端重新開始,如果仍然“讀”不過去,Rep就會重複這個過程。這也是Taekjip Ha教授利用FRET成功分析DNA複製過程的一個範例。
單分子FRET是對單個分子的熒光特性進行檢測的過程,因為幾乎所有的分子生物學實驗結果只代表測量時間內大量分子的平均行為 ,而生物體系一般來說都是不均勻體系 ,尤其對於生物大分子而言。因此監測單個生物大分子的行為具有重要意義。
FRET最基本的原理是通過易於檢測的熒光共振能量轉移的效率信息來反映兩分子團的距離信息,而距離接近到 10 nm之間是兩分子相互作用或一個分子的兩個結構域因構象改變而相互靠近的有力證據。通過 FRET效率的增強可檢測分子間發生相互作用或構象改變而靠近;FRET效率的減弱可用於證明兩分子遠離因而失去相互作用,或證明一個分子的兩個部分間因分子被切斷或構象改變而相互遠離。
在分子水平上研究任何生物學機制都可以運用FRET技術,關鍵在於找到合適的熒光探針和檢測設備。事實上FRET方法的應用領域非常廣泛。在核蛋白機制、細胞外基質、生物膜功能、信號轉導等多個方向領域都可以找到FRET技術的應用案例。這一技術無疑已成為細胞分子機制研究的重要工具。
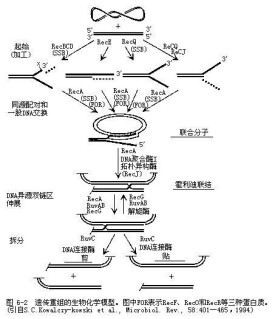
1、E.coli及噬菌體的解旋酶
| 表11-2 E.coli及噬菌體的解旋酶 | ||
| 解旋酶 | 結構 | 功能 |
| DnaB | 330 kD六聚體 | 結合於oriC,oriλ參與前引發,分離雙鏈,水解ATP提供能量 |
| rep蛋白 | 66 kD單體 | ATP依賴性解旋酶,在φX174滾環複製中推進複製叉 |
| PriA(n′蛋白) | 82 kD單體 | φX174Rf形成中參與前引發體3′→5′移動,取代SSB,識別特異位點 |
| TraY/I | 多聚體 | F因子滾環複製中解鏈 |
| 基因4蛋白 | 58 kD | T7噬菌體複製中延5′→3′解鏈 |
合成位置:存在於核膜上的核糖體,通過核孔進入細胞核內。
2、TFⅡ-F 和TFⅡ-H(有解旋酶活性)
轉錄前先是TFⅡ-D與TATA盒結合; 繼而TFⅡ-B以其C端與TBP-DNA複合體結合,其N端則能與RNA聚合酶Ⅱ親和結合; 接著由兩個亞基組成的TFⅡ-F加入裝配,TFⅡ-F不僅能與RNA聚合酶形成複合體,還具有依賴於ATP供給能量的DNA解旋酶活性,能解開前方的DNA雙螺旋,在轉錄鏈延伸中起作用. 這樣,啟動子序列就與TFⅡ-D、B、F及RNA聚合酶Ⅱ結合形成一個有轉錄功能基礎的“最低限度”轉錄前起始複合物(pre-initiation complex,PIC),轉錄mRNA. TFⅡ-H是多亞基蛋白複合體,具有依賴於ATP供給能量的DNA解旋酶活性,在轉錄鏈延伸中發揮作用; TFⅡ-E是兩個亞基組成的四聚體,而可能與TFⅡ-B聯繫不直接與DNA結合,能提高ATP酶的活性; TFⅡ-E和TFⅡ-H的加入就形成了完整的轉錄複合體,能轉錄延伸生成長鏈RNA.
解旋酶
核酸等溫擴增技術及其應用:一直以來,病原微生物的體外培養是病原體診斷的“金標準”。據微生物學家的估計,採用培養技術,僅有約1%的細菌可以培養。在過去的一個世紀里,以聚合酶鏈反應(PCR)為代表的基於核酸的檢測技術發展迅速,為其他病原體的精確檢測診斷提供了可能。毋庸置疑,Kary Mtlllis發明的PCR技術是20世紀80年代分子生物學領域的一項革命性突破。也許他本人當時也沒有想到,PCR技術會在分子生物學、醫學、法學等領域發揮如此重要的作用。經過幾十年的改進,PCR方法已從定性發展為定量,能夠在幾個小時內,從幾個拷貝或單個細胞開始擴增到數十億特異性的核酸片段,而且特異性也有了極大的提高。然而,從PCR技術的誕生之日起,它始終無法擺脫依賴精良儀器設備的局限,使得以PCR為基礎的核酸擴增檢測技術無法更廣泛地推廣和應用。
基於這種強烈的需求,以核酸等溫擴增技術為基礎的檢測技術得到了迅猛的發展。多種機制的等溫技術不僅誕生,而且有些技術已經相當成熟,完成了從實驗室到實際應用的過渡,正逐步在分子生物學、醫學、法學等領域得到廣泛運用。特別是在臨床和現場(point-of-care)快速診斷技術方面,核酸等溫擴增技術顯示了其突出的優越性。更為重要的是,核酸等溫擴增技術由於不需要溫度變化的時間過程且擺脫了對精良儀器設備的依賴,使得我們對病原體的檢測診斷得以快速並高通量的實現。
注
轉錄酶是一類酶,RNA聚合酶I、Ⅱ和Ⅲ。各自的作用為RNA聚合酶I負責rRNA基因的轉錄,RNA聚合酶Ⅱ負責轉錄產生mRNA前體,RNA聚合酶Ⅲ負責tRNA、5SRNA、Alu序列和其他小RNA的生成。
當然轉錄還包括解旋酶等。還提一下:翻譯主要就是核糖體大亞基起到肽醯轉移酶的作用。