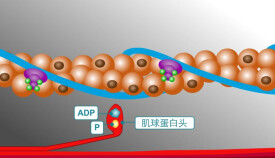
肌球蛋白
肌原纖維粗絲的組成單位
肌球蛋白(myosin)肌原纖維粗絲的組成單位。存在於橫紋肌和平滑肌中。在肌肉運動中起重要作用。其分子形狀如豆芽狀,由兩條重鏈和多條輕鏈構成。兩條重鏈的大部分相互螺旋形地纏繞為桿狀,構成豆芽狀的桿;重鏈的剩餘部分與輕鏈一起,構成豆芽的瓣。被激活后,具有活性的、能分解ATP的ATP酶。其分子量約為51萬。在粗絲中,都是分子的頭朝向粗絲的兩端,呈縱向線性締合排列。
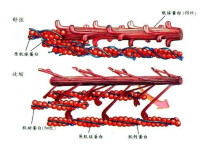
肌球蛋白
肌球蛋白(myosin)是沿著肌動蛋白絲軌道運動的分子馬達超大家族,最初是由Kuehne在1864年研究骨骼肌收縮時發現並命名的。在最初試圖要尋找非肌肉肌球蛋白,首先發現了單頭肌球蛋白,隨後是傳統的雙頭肌球蛋白。後來,將前者稱為“肌球蛋白I”,後者“肌球蛋白Ⅱ”。從此之後,根據發現的時間順序用羅馬數字給肌球蛋白命名,真核細胞中的肌球蛋白可以分為從I到XXXV的35類肌球蛋白種類。
依據來源,可以將肌球蛋白分為兩類:傳統的肌球蛋白和非傳統的肌球蛋白。傳統的肌球蛋白指那些構成肌肉的肌球蛋白,也就是肌球蛋白Ⅱ,最早發現於動物細胞的肌肉組織和細胞質中,主要為肌肉收縮提供驅動力,能夠把ATP水解釋放出來的化學能轉化為肌肉收縮的機械能。但是非肌肉細胞中也存在肌球蛋白Ⅱ,稱為非肌肉肌球蛋白Ⅱ。非傳統的肌球蛋白指的是那些肌肉中不含有的肌球蛋白,如肌球蛋白I、Ⅲ、ⅣV、V,等只存在於非肌肉細胞之中;肌球蛋白VⅢ,Ⅺ和xⅡ只存在於植物當中。
肌球蛋白
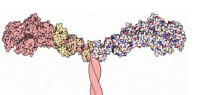
肌球蛋白的頭部,分子量為80kDa,通常位於氨基末端。在所有的肌球蛋白種類中,馬達域的核心序列是高度保守的。不同的肌球蛋白馬達域的結構是非常相似的,由多個α螺旋包圍的7個β摺疊鏈組成。馬達域包含兩個重要的結合位點:核苷酸結合位點和肌動蛋白結合位點。肌動蛋白結合位點被深裂口分開,根據ATP的結合與否而開或關。ATP結合位點由一個P環構成,類似於驅動蛋白,說明肌動蛋白和驅動蛋白的運動有一個相似的與ATP有關的構象變化機制。
肌球蛋白的頸部由一個長的α螺旋構成,攜帶1到6個特有的IQ模體。這些IQ模體有致的鈣調蛋白結合序列(QXXXRGXXXR),每個IQ模體都含有一個鈣調蛋白或鈣調蛋白家族成員的結合位點,頸部區域通過結合鈣調蛋白或相關的輕鏈而得以穩定,且能夠傳導和放大馬達域受ATP影響的構象變化,在ATP水解后,產生動力衝程,所以有時頸部也被稱為桿臂。不同的肌球蛋白,頸部長度不同。肌球蛋白Ⅴ頸部比較長,約24mm,大約是肌球蛋白Ⅱ的3倍長。
肌球蛋白的尾部通常位於羧基末端,是一個超螺旋結構,其序列、長度、域成分和組織極其易變。肌球蛋白之間最本質的區別在於球狀尾部。尾部含有為不同的“貨物”提供的特定結合位點。這一結構域通過直接作用或通過接頭蛋白來識別各種“貨物”,決定肌球蛋白的細胞定位(靶向)和功能。
肌球蛋白
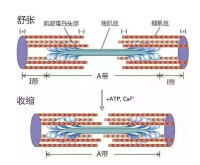
肌球蛋白作為細胞骨架的分子馬達,是一種多功能蛋白質,其主要功能是為肌肉收縮提供力。纖絲滑動學說(sliding filament theory)認為肌肉收縮是由於肌動蛋白細絲與肌球蛋白絲相互滑動的結果。在肌肉收縮過程中,粗絲和細絲本身的長度都不發生改變,當纖絲滑動時,肌球蛋白的頭部與肌動蛋白的分子發生接觸(attachment)、轉動(tilting),最後脫離(detachment)的連續過程,其結果使細絲進行相對的滑動。
肌球蛋白也廣泛存在於非肌細胞中,它是細胞骨架的組成成分,為細胞質流動、細胞器運動、物質運輸、有絲分裂、胞質分裂和細胞的頂端生長等提供所需的力,參與細胞的吞噬、運動、受精和吸收等生理過程,充當非肌細胞生命活動的不同層次的調節者,從簡單的細胞間的信號傳遞到指導向化性遷移和細胞形狀的改變等較高級的調節。研究表明,肌球蛋白為盤基網柄菌在振蕩培養下正常生長和分裂、表面蛋白受體成帽(surface receptor capping)、多細胞發育成子實體(fruiting body)、細胞與器壁的脫粘附(adherence)等生命活動所必需。閻隆飛等在80年代的研究結果表明,肌球蛋白在高等植物如黃瓜等花粉管伸長和豌豆葉片卷鬚運動中可能執行重要功能。Kinkema等(1994)證明植物肌球蛋白在植物生長發育的不同時期及不同部位有不同的生理功能。