鍵角是分子中鍵和鍵之間的夾角,也是共價鍵的參數之一,它是反映分子空間幾何結構的重要因素。
鍵角
例如
H2O分子中兩個H-O鍵的夾角為104.5°,
CO2分子中兩個C=O鍵間的夾角為180°。鍵長和鍵角決定分子的空間構型。H2O和CO2同是三原子分子,但H2O分子是V形而CO2分子是直線形。
NH3分子中三個 N-H鍵的鍵長相等,兩個 N—H鍵之間的夾角為 107°18′,NH3分子呈三角錐形。又如
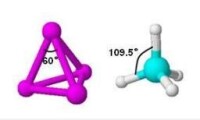
CH4分子,四個C—H鍵的鍵長相等,C—H鍵之間的夾角均為109°28′,CH4分子是正四面體形。周期表中,同族
非金屬元素的氫化物或鹵化物,組成相似,分子結構相同,例如第ⅣA族元素形成的CH4、
CCl4、
SiH4、
SiF4等,它們的分子均是正四面體結構。又如
氧族的氫化物H2O、
H2S、
H2Se等,它們的分子均是V形結構。
鍵能形成一摩爾共價鍵放出的能量或拆開一摩爾共價鍵成為
原子需要吸收的能量。
鍵能的單位是千焦/摩。例如H—H鍵的鍵能為436千焦/摩,表示形成一摩爾H—H鍵放出的能量或拆開—摩爾H-H鍵需要吸收的能量均為436千焦/摩。鍵能又稱
解離能。鍵能的大小標誌著共價鍵的強弱,鍵能越大,鍵越牢固,該分子越穩定。例如Cl2和I2的鍵能分別為239.74千焦/摩、148.95千焦/摩。對於分子,
Cl2比I2穩定,對於原子,
Cl比I活潑。若用Q表示反應熱,E表示鍵能,則任何一個化學反應的反應熱與鍵能的關係是:
Q=∑E生成物-∑E反應物。
