比色分析法
比色分析法
比色分析法是利用被測溶液本身的顏色,或加入試劑后呈現的顏色,用眼睛(或目測比色計)觀察、比較溶液顏色深度,或用光電比色計進行測量以確定溶液中被測物質濃度的方法。比色法包括目視比色法和光電比色法。
物質的顏色與光的關係
光是一種電磁波,自然是由不同波長(400~700nm)的電磁波按一定比例組成的混合光,通過稜鏡可分解成紅、橙、黃、綠、青、藍、紫等各種顏色相連續的可見光譜。如把兩種光以適當比例混合而產生白光感覺時,則這兩種光的顏色互為補色。
當白光通過溶液時,如果溶液對各種波長的光都不吸收,溶液就沒有顏色。如果溶液吸收了其中一部分波長的光,則溶液就呈現透過溶液后剩餘部分光的顏色。例如,看到KMnO溶液在白光下呈紫色,就是因為白光透過溶液時,綠色光大部分被吸收,而紫色光透過溶液。同理,CuSO溶液能吸收黃色光,所以溶液呈藍色。由此可見,有色溶液的顏色是被吸收光顏色的補色。吸收越多,則補色的顏色越深。比較溶液顏色的深度,實質上就是比較溶液對它所吸收光的吸收程度。表10-1列出了溶液的顏色與吸收光顏色的關係。
比色分析法
朗伯-比爾定律(Beer-Lambert Law),是光吸收的基本定律,適用於所有的電磁輻射和所有的吸光物質,包括氣體、固體、液體、分子、原子和離子。朗伯吸收定律的數學表示為I=Iexp[-al]。其中A是吸收率,表示單位厚度的媒質吸收光功率的百分數。如果媒質是均勻透明溶液,則對光的吸收量應與溶液內單位長度光路上的吸收分子數目成正比,這又與溶液的濃度C成正比,所以吸收率A也與濃度C成正比:A=βC,β是溶液對波長久的吸收係數,僅由媒質分子決定,與溶液濃度C無關。比爾-朗伯定律是吸光光度法、比色分析法和光電比色法的定量基礎。光被吸收的量正比於光程中產生光吸收的分子數目。
元素不同價態的離子都有著該元素離子特定的顏色。比如二價銅離子是藍色的,而一價銅離子卻是無色的;三價鉻離子是綠色的,而六價鉻離子則是棕色的。離子除了各自特定的顏色以外,這種顏色深淺還與離子的濃度有嚴格的線性關係,只要沒有其他干擾因素,離子的這種顏色與在溶液中的濃度的比例關係,可以用來對溶液中的離子濃度進行對比分析。這種通過離子顏色來分析溶液中離子濃度的方法稱為比色分析法。
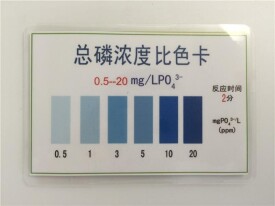
具體的做法是預先將需要確定其含量的鍍液配製成標準濃度的標準液。然後用蒸餾水按不同等分地稀釋成比如80%、70%、60%、50%等不同濃度的標準液。裝進乾淨的試管中備用。當需要對待測的工作液進行濃度分析時,只要取同樣的試管,將被測液裝進試管后,拿來與已知濃度的標準溶液試管進行顏色的對比,總可以找到一個與之相同或接近的標準,用來確定被測液的濃度。
常用的目視比色法為標準系列法,是藉助於與一系列標準溶液進行比較以測定樣品溶液濃度的方法。用一套由相同質料製造的、形狀大小相同的比色管(容量有10、25、50及100ml等),將一系列不同量的已知濃度的標準溶液依次加入各比色管中,再分別加入等量的顯色劑及其他試劑,並控制其他實驗條件相同,最後稀釋至同樣體積,這樣便配成一套顏色逐漸加深的標準色階。將一定量的被測試液置於另一比色管中,在同樣條件下進行顯色,並稀釋至同樣體積。從管口垂直向下注視,若試液與標準系列中某溶液的顏色深度相同,則說明這兩隻比色管中溶液的濃度相等;若被測試液的顏色深度介於相鄰兩個標準溶液之間,則試液濃度也就介於這兩個標準溶液濃度之間。
標準系列法設備簡單,操作簡便,適宜於大批樣品的分析。其缺點是靠人的眼睛來觀察顏色的深度,有主觀誤差,因而準確度較差,目前多為光電比色法所代替。
光電比色法藉助於光電比色計來測量一系列標準溶液的吸光度,繪製工作曲線,然後根據被測試液的吸光度,從工作曲線上求得其濃度或含量。
光電比色法與目視比色法原理上並不完全一樣,光電比色法是比較有色溶液對某一波長光的吸收情況,而目視比色法是比較透過光的強度。例如測定溶液中KMnO溶液的含量,光電比色法測量的是KMnO溶液對黃綠色光的吸收情況;目視比色法是比較KMnO溶液紅紫色光透過的強度。
比色分析具有簡單、快速、靈敏度高等特點,廣泛應用於微量組分的測定。通常測定含量在10~10mg/L的痕量組分。比色分析如同其他儀器分析一樣,也具有相對誤差較大(一般為1%~5%)的缺點。但對於微量組分測定來講,由於絕對誤差很小,測定結果也是令人滿意的。在現代儀器分析中,60%左右採用或部分採用了這種分析方法。在水處理中,比色分析被廣泛應用於水質分析。
比色分析簡便、快速,所用儀器不複雜,若使用新的特效有機顯色劑和配合掩蔽劑,常可不經分離而直接測定。因此比色分析已成為工農業生產、醫藥衛生、環境保護和科學實驗等方面測定微量及痕量組分廣泛應用的方法。幾乎所有的無機離子和許多有機化合物都可直接或間接用光電比色測定。