ATP合成酶
ATP合成酶
ATP合成酶,又稱FoF₁-ATP酶在細胞內催化能源物質ATP的合成。在呼吸或光合作用過程中通過電子傳遞鏈釋放的能量先轉換為跨膜質子(H)梯差,之後質子流順質子梯差通過ATP合酶可以使ADP+Pi合成ATP。
ATP合酶(ATP synthase)廣泛分佈於線粒體內膜,葉綠體類囊體,異養菌和光合菌的質膜上,參與氧化磷酸化和光合磷酸化,在跨膜質子動力勢的推動下合成ATP。分子結構由突出於膜外的F1親水頭部和嵌入膜內的Fo疏水尾部組成。
ATP合成酶
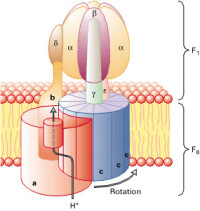
ATP合酶主要由F₁(伸在膜外的水溶性部分) 和Fo(嵌入膜內)組成(圖1)。不同物種來源的 ATP合酶含的亞基和數目不盡相同。以牛心線粒體 ATP合酶為例,它的F₁含有僅α3、β3、γ、δ、ε共9 個亞基,Fo含a、b2、C10共13個亞基,F₁與Fo之間有OSCP柄相連接,還有抑制蛋白。線粒體F₁Fo-ATP酶的總分子量約為500 ku。對大腸桿菌ATP合酶的研究較為詳盡,它的F₁含5種亞基α、β、γ、δ、ε,分子量分別是55.3、50.3、31.6、19.3和14.9 ku。准量關係為α3、β3、γ、δ和ε。F₁的總分子量為382 ku。Fo由a、b、c 3種亞基組成,分子量分別為30.3、17.2和8.3 ku,准量關係為a,b2,C9-12。Fo的總分子量約為164 ku,因此大腸桿菌F₁Fo一ATP酶的總分子量共為546 ku。葉綠體ATP酶由CF₁和CFo兩部分組成,它們的亞基的組成和分子量與上述兩種ATP合酶大體相似,但又有一定的差異。
ATP合酶結構
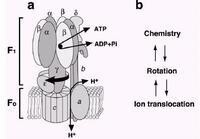
F1由5個不同的亞基組成,用化學計量法表示是α3β3γ1δε1。通過對牛F1部分的X-Ray晶體衍射分析,得到了一個很確切的結構—α3β3γ集合體。α和β亞基的三個重複結構輪流圍繞在γ亞基α螺旋結構的氨基和羧基末端。此外,重要的是三個β亞基在結合核苷酸後會處於不同的狀態:βT, βD和βE。β亞基的不均勻性結構與酶的接觸反應部分相比,顯然是一致的。
F0是由三個亞基構成,化學計量法表示是a1b2c10-12。c和a亞基的cAsp-61和aArg-210對質子遷移分別獨立作用。同時提出了具有12個c亞基的環狀結構,並且電子顯微鏡、原子粒顯微鏡也這樣提示,而且單個c亞基的核磁共振形成的模型擁有兩個跨膜α螺旋結構。
描述的是Escherichia coli 的F1F0結構。蛋白是具有兩個方向的。F1部分包括α3,β3,γ,δ和ε亞基,F0部分包含a,b和c亞基,測定其化學含量比為1:2:10-14。F1和F0由兩個細莖連在一起,中心的一條連接γ和ε亞基,外圍的那條則旋繞δ和b亞基。在哺乳動物,通常會有額外的亞基在細莖部位。
ATP合成酶位置
ATP合酶在線粒體內膜上的分佈不對稱,數量也不相等。
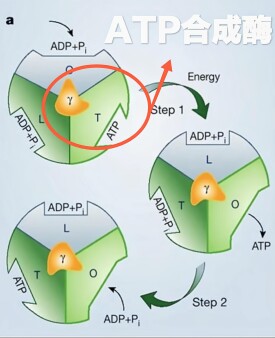
F1部分包含3個結合位點,在每一個β亞基上。當少量的ATP增加時,這些結合位點被佔據,底物結合的就非常緊密並且ATP的水解發生得非常緩慢。過量的ATP則導致其可結合在所有的結合位點上,並且伴隨產生的是在第二和第三個位點上具有很低的底物親和力。且第三位點的使用率若增加,ATP的水解率則增加104~105。
F1部分是一個有效的三倍複合體,由三個α亞基和β亞基組成,其具有與底物結合強的負協調性質,同時亦具有酶活性的正協調性質。為了解釋這些特殊的部分,Boyer提出“結合導致變化”或者稱為“抉擇位點”的假想。這則假想的關鍵特徵是三個結合位點,和因此由三個α和β亞基配對形成的這些位點,在任何時期有不同的信息。一個開放並且準備ATP(或者ADP+Pi)結合,而第二和第三個位點則圍繞著一定的核苷酸,部分獨立的開放或者關閉。ATP結合物和開放位點關閉的結果可以產生協調信息的變化,其他的兩個位點也發生了改變,導致關閉的位點成為了部分開放,而部分開放的位點成為全部開放。如此,每個位點當ATP水解時,在三個狀態下發生變化,在相反的過程中,即當ATP合成時,同樣發生變化。一些構象調節的細節表明三組αβ配對亞基一起同時被調控,然而對於在每一時期每一位點ATP合成或者分裂過程中,其反應的中止仍然有爭議。
電子顯微鏡研究表明在α3β3構成的環中,γ亞基具有旋轉性。這在80年代就已經證明。這些分析令人信服的顯示了α和β亞基圍繞這個六邊體發生的改變,六邊體包含一個中心物質,這已經被認定是γ亞基。
F1部分,化學能促使γ亞基旋轉。確切的結構揭示了γ亞基與三個β亞基分別的相互作用。與結構上的特徵一致,γ亞基上的突變常常抑制ATP合成/水解,或者影響能量的配對,並且這些突變可受β亞基上的第二個突變抑制。此外,在氨基末端的突變也可受羧基端的突變抑制。類似的,羧基端的突變亦受氨基末端突變的抑制。然而這兩個區域並不直接的相互作用,所觀察到的現象是長距離抑制現象,這提示在催化過程中,γ亞基的構象有一個大的改變。
當β亞基在催化過程中進行一系列構象的變化時(βTβDβE)),在α3β的六邊體里,γ亞基也相應的改變著構象。這種位置的改變最有可能的機制是γ亞基在六邊體里自我的旋轉所導致。γ亞基的旋轉已經由一流的生物化學試驗所提示,包括β/γ亞基的化學交聯,連接γ亞基的探針漂白後偏震現象的恢復,這些均已發現。ATP水解時的旋轉藉助連接嗜溫的桿狀菌γ亞基的肌絲蛋白所記錄。在這個試驗當中,F1通過一個插入β亞基氨基末端的組氨酸標籤固定在玻璃的表面。隨著旋轉,扭力發生,與生理學ATP水解釋放的自由能相比,扭力接近40~50pN nm。因此,αβ3γ複合物是一個將化學能轉變為機械能的有效的分子發動機。
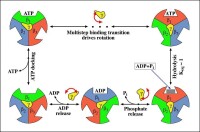
ATP合成過程
F0旋轉子的旋轉機制:依賴a亞基c環的活動。與F1相比,ATP合成酶中另一個已經很好詮釋的部分是F0,然而在基本的機械模型中,沒有一個能夠解決F0的結構。目前F0結構模型來源於核磁共振中測得的單個c亞基分子的結構,並且同時參考酵母菌F1F0複合物部分X-Ray和原子粒顯微鏡研究數據得出模型結構,所有的這些數據支持圖1中的環狀排列。對c亞基和a亞基之間的表面假設的質子通道的研究,採用了突變的研究方法,並且證實c亞基的Asp61和a亞基的Arg210是質子轉移的關鍵氨基酸。
有的人通過實驗發現來源於細菌的F1F0可以像泵質子一樣泵Na+,簡單的複合物研究發現當酶激活時,離子在遷移。另外通過致突變研究,去掉Na+遷移,而Li+或者H+保留;現a亞基發生了一些改變。同時也發現在這個誘導的突變中,Na+抑制了ATP的水解,這是因為鈉質子通道陽離子的吸引作用。這強有力的證明了F0部分時作為一個單獨的通道而起作用的。
對這個機制的任何細節上的解釋顯然都需要了解環上c亞基的數目,但是對其精確的測量證明是很困難的。總結以往的實驗數據,c亞基的化學計量不同的種屬有不同的數據,並且依賴代謝條件,同一個個體都會不同。根據X-Ray數據,酵母菌有10個c亞基。做對照,原子粒顯微鏡發現P.modestum和葉綠體F0各自有11和14個。
邏輯上很容易設想固定的部分和旋轉的部分可以互換,因為F0F1沒有被固定在膜上。那麼F1上固定的亞基如αβ,在旋轉子εγс0-12聚集時可以不動。利用與上述相仿的實驗,我們檢驗了這個問題,發現只要εγс10-12聚集形成一個機械單位,肌絲的旋轉就會觀察到。藉助遺傳工程,將α亞基和с亞基分別連接生物素標籤和組氨酸標籤,這樣沒有化學能來獲得肌絲蛋白裝配的特殊性。裝配到α亞基的肌絲蛋白能夠在ATP水解時旋轉並且產生~40pN nm的扭力。這個現象是表明F0F1是一個旋轉酶的另外證據,並且α和с亞基複合物的旋轉是在質子轉移和ATP水解/合成之間能量耦合的必備特徵。
從上述可以看出,ATP合成酶是一個毫微發電機,它可以將化學能、滲透壓和機械能量互換。另外,還有一個未回答的問題是,γ和с亞基的低聚合物旋轉子如何能夠從F1的接觸位點釋放出ATP並且通過F0逆向傳遞質子?這需要我們進一步的研究。
21世紀是納米科技的世紀。高集成、智能化納米器件的開發必將推動信息技術、生物技術、新材料技術、能源技術及環境技術等的高速發展。納米技術是國際科技競爭的前沿,也是對未來社會發展、經濟振興、國力增強最有影響力的戰略研究領域。人工納米機器的構建與應用是此前沿領域國際上最具有挑戰性的熱點課題之一。
21世紀也是生命科學的世紀。生命活動是自然界最精巧的運動方式,它賴以存在的基礎是生物大分子能夠響應外界刺激(包括環境及外場條件的改變)。近20年來,分子生物學和單分子生物物理學所取得的突破性進展揭示了生物分子馬達在生命過程中扮演著核心角色。這些過程包括ATP合成,基因轉錄、翻譯,物質輸運,細胞運動與分裂等。因此,科學界已全面確立了將蛋白酶理解為生物單分子機器的觀點。生物分子馬達的發現一方面使人們對生命的複雜有序有了新的認識,另一方面也啟示和激發科學家去建造能與自然相媲美的納米機器。
(1)如何獲得Fo的精細結構圖像;
(2)質子通道c環與蛋白a之間的相互作用機制;
(3)質子流向與馬達轉向的對應切換機制;
(4)“轉子”γ軸的儲能機制;
(5)“定子”上的化學循環與“轉子”的步進式轉動之 問如何實現高效的力學化學耦合;
(6)三個催化位點順序可逆的構象變換:βo→←βL,βL→←βT和βT→←βo,與γ近距離的相互作用關係;
(7)三個催化位點全都結合核苷才能推動馬達轉動 還是只需要其中兩個結合;
(8)ADP和R與催化位點的結合和去結合是順序還是隨機的;
(9)催化位點聚合方向的構象變化是否有利於ADP和Pi的結合,反之。水解方向的構象變化是否有利於ATP的結合等。