有色離子
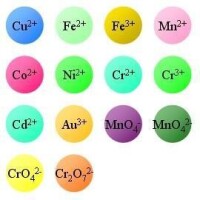
呈現不同顏色的離子
有色離子(Colored ion)
在水溶液中,有些離子是有色的。
有色離子的顏色
Cu 銅離子-----------藍色
Fe 亞鐵離子-----------淺綠色
Fe 鐵離子 -----------淡紫色(溶液中一般呈現棕黃色)
Mn 錳離子-----------淺粉色
Co 鈷離子-----------粉色
Ni鎳離子---------綠色
Cr亞鉻離子 -----------藍綠色
Cr鉻離子 -----------綠色
Cd 鎘離子 -----------藍綠色
Au 金離子--------金黃色
高錳酸根離子 ----------紫紅色
錳酸根離子 ---------墨綠色
鉻酸根離子 ---------黃色
重鉻酸根離子 --------橙色
硫氰合鐵絡離子------血紅色
四氯合銅絡離子--------黃色
遇到時的顏色--------血紅色
鐵氰化鉀遇二價鐵離子——--——藍色沉澱在水溶液中,有些離子是有色的。
有色離子的顏色
1. 有色氣體:
2. 液體:
3. 有色固體:紅色
紅褐色
綠色:
藍色:
黑色:
淺黃色:
黃色:
4. 有色溶液:。
5. 焰色反應:
6. 使品紅褪色的氣體:
顏色變化的反應:
1.蛋白質遇硝酸變黃(如做實驗時,被某液體濺到皮膚上,皮膚變黃)
2.酚類遇Fe顯紫色
有色離子
4.Fe(淺綠色或灰綠色)遇比較強的氧化劑變成Fe(黃色)
5(白色),在空氣或溶液中會迅速變為灰綠色沉澱,最後變為紅褐色沉澱.
6.白色無水硫酸銅溶於水會變藍
7.澱粉遇碘變藍
9.二氧化硫通入品紅溶液,品紅溶液褪色,但非氧化漂白,再加熱品紅溶液,顏色恢復.
12.
13. (由於技術有限,這裡的等號應為可逆號)(正反應條件是加壓,逆反應條件反之)
15.醛基與銀氨溶液反應生成光亮的銀鏡 (反應要在水浴中進行)
16.醛基與新制氫氧化銅懸濁液反應,反應現象是藍色絮狀沉澱(Cu(OH))到磚紅色沉澱(CuO)
17.無機反應(沉澱或有色離子) 等等都是生成白色沉澱
18. Cu與鹼生成藍色沉澱.
19.Fe與鹼生成但它易被氧化,所以實驗現象中沒有我們期望的白色沉澱,而是灰綠色沉澱,過一段時間最終形成紅褐色沉澱.
20.Fe與鹼生成紅褐色絮狀沉澱
21.溴蒸汽呈紅棕色
22.液溴呈深紅色
23.溴的四氯化碳呈橙紅色
24.碘單質呈紫黑色
25.碘蒸氣呈紫紅色
26.碘的四氯化碳呈紫紅色
27.氯氣呈黃綠色
28.氟氣呈淡黃色
物質特性
在化學上面叫亞的物質的化學價一定比其的最高的化學價低 但是不一定是處於中間的化學價(如氯的化學價就有化學價 +7價為它的最高的化學價 只有+3才被稱為亞)
注意:亞鐵鹽水溶液大多為淺綠色,但是氫氧化亞鐵[Fe(OH)]為難溶於水的白色固體。
水中的亞鐵離子在成熟濾層中被去除,經歷以下諸步驟:亞鐵離子由水中向濾料表面擴散;亞鐵離子被濾料表面的活性濾膜吸附;被吸附的亞鐵離子水解並被氧化,生成高鐵氫氧化物——鐵質活性濾膜。上述諸步驟中,反應速度最慢者將成為除鐵速率的控制步驟。實驗表明,亞鐵離子向濾料表面擴散可能是除鐵速率的控制因素。實驗還表明,濾料上活性濾膜只以外表面吸附水中的亞鐵離子。
(1)
式中 t——時間,;
l——濾層的厚度;
m——濾層孔隙度;
u——濾速;
D——擴散係數;
S——單位體積濾層中濾膜的外表面積,;
d——濾料粒徑;
a——濾料的形狀係數;
σ——邊界層厚度;
C’——濾膜表面上的亞鐵離子濃度。
將上列各參數代入式(1)得
(2)
(3)
式中β稱為濾層的接觸催化活性係數。
當水在濾層中呈層流狀態流動時,可以認為邊界層厚度為一定值()。
Fe(OH)沉澱時的pH:Fe從開始沉澱到沉澱完全時溶液的pH(常溫下):。
Fe(OH)氧化為為Fe(OH)的顏色變化:Fe(OH)沉澱氧化為為Fe(OH)時顏色變化為白色到灰綠色再到紅褐色。
