極性溶劑
極性溶劑
極性溶劑是指含有羥基或羰基等極性基團的溶劑,即溶劑分子為極性分子的溶劑,由於其分子內正負電荷重心不重合而導致分子產生極性。用於表徵分子極性大小的物理量為偶極矩或介電常數,介電常數大表示其極性大。
極性鍵與非極性鍵
首先化學共價鍵分為極性鍵與非極性鍵。非極性鍵就是共用電子對沒有偏移,出現在單質中比如O;極性鍵就是共用電子對有偏移比如HCl。而當偏移的非常厲害之後,看上去一邊完全失電子另一邊得到了電子,就會變成離子鍵了,如NaCl。
極性分子與非極性分子
由於極性鍵的出現,所以就使某些分子出現了電極性,但是並不是說所有有極性鍵的分子都是極性分子。比如CH,雖然含有4個極性的C-H鍵,但是因為其空間上成對稱的正四面體結構,所以鍵的極性相消,整個分子沒有極性。
對於HO,雖然與CO有相同類型的分子式,也同樣有極性共價鍵,但二者分子的極性卻不同。CO是空間對稱的直線型,所以分子是非極性分子,HO是折線型,不對稱,所以是極性分子,作為溶劑稱為極性溶劑。
化合物的極性決定於分子中所含的官能團及分子結構。各類化合物的極性按下列次序增加:
—CH,—CH—,—CH=,—C三,—O—R,—S—R,—NO,—N(R),—OCOR,—CHO,—COR,—NH,—OH,—COOH,—SOH
化學式中的R表示的是烷基基團
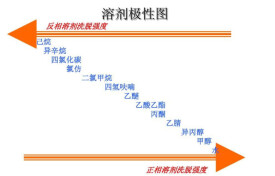
常用溶劑的極性順序
常用溶劑的極性順序:水(最大)>甲醯胺>三氟乙酸>DMSO>乙腈>DMF>六甲基磷醯胺>甲醇>乙醇>乙酸>異丙醇>吡啶>四甲基乙二胺>丙酮>三乙胺>正丁醇>二氧六環>四氫呋喃>甲酸甲酯>三丁胺>甲乙酮>乙酸乙酯>氯仿>三辛胺>碳酸二甲酯>乙醚>異丙醚>正丁醚>三氯乙烯>二苯醚>二氯甲烷>二氯乙烷>苯>甲苯>四氯化碳>二硫化碳>環己烷>己烷>煤油(石油醚)(最小)
常用的極性溶劑有:
(1)水
水不具有任何藥理與毒理作用,且廉價易得。所以水是最常用的和最為人體所耐受的極性溶劑。水能與乙醇、甘油、丙二醇及其他極性溶劑以任意比例混合。水能溶解無機鹽以及糖、蛋白質等多種極性有機物。液體製劑用水應以蒸餾水為宜。水的化學活性較有機溶劑強,能使某些藥物水解,也容易增殖微生物,使藥物霉變與酸敗,所以一般以水為溶劑的製劑不易久貯。在使用水作溶劑時,要考慮藥物的穩定性以及是否產生配伍禁忌。
(2)乙醇
乙醇也是常用的溶劑。可與水、甘油、丙二醇以任意比例混合,能溶解生物鹼、揮髮油、樹脂等有機物,具有較廣泛的溶解性能。乙醇的毒性小於其他有機溶劑。含乙醇20%以上即具有防腐作用,40%以上則能抑制某些藥物的水解。但乙醇本身具有藥理作用。與水相比存在成本高及易揮發、易燃等缺點。
(3)甘油
本品為黏稠狀液體,味甜、毒性小,可供內服與外用。甘油能與乙醇、丙二醇、水以任意比例混合,能溶解許多不易溶於水的藥物,如硼酸、鞣酸、苯階等。無水甘油有吸水性,對皮膚黏膜具有一定的刺激性,但含水10%的甘油則無刺激性,且對藥物的刺激性有緩解作用。甘油由於黏度大,化學活性相對水較弱,並且在30%以上具有防腐性,故常用於外用液體製劑。在內服溶液製劑中,甘油含量在12%(g/ml)以上能防止鞣質的析出併兼有矯味作用。但過多的甘油含量會產生刺激性,且黏度大、成本高,故在使用中受到一定的限制。
(4)丙二醇
丙二醇的性質基本上同甘油相似,但其黏度較小、毒性與刺激性均較小。藥用丙二醇應為1,2-丙二醇,可作為內服及肌內注射用溶劑。丙二醇同樣可與水、乙醇、甘油以任意比例混合,能溶解諸多有機藥物,如磺胺類藥物、局麻藥、維生素A、D及性激素等。同時可抑制某些藥物的水解,增加穩定性,但因其具有辛辣味,放在口服製劑的應用中受到一定限制。