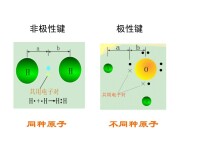
極性鍵
不同種原子形成的共價鍵
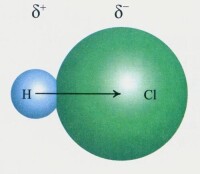
在化合物分子中,不同種原子形成的共價鍵,由於兩個原子吸引電子的能力不同,共用電子必然偏向吸引電子能力較強的原子一方,因而吸引電子能力較弱的原子一方相對的顯正電性,這樣的共價鍵叫做極性共價鍵,簡稱極性鍵。非極性鍵,同種元素的原子形成的共價鍵,共用電子不偏移,電中性。
氧氣分子
並不是只有非金屬元素之間才有可能形成極性共價鍵,金屬與非金屬之間也可以形成極性共價鍵(比如,等),一般來說,只要兩個非金屬原子間的電負性不同,且差距小於1.7,則形成極性鍵,大於1.7時,則形成離子鍵。
附註:極性鍵介於離子鍵和非極性鍵之間。
以下為常見的極性分子:
如果分子的構型不對稱,則分子為極性分子(polar molecules)。如:氨氣分子,HCl分子等。區分極性分子和非極性分子的方法:非極性分子的判據:中心原子化合價法和受力分析法
組成為ABn型化合物,若中心原子A的化合價的絕對值等於族的序數,則該化合物為非極性分子。如:
若已知鍵角(或空間結構),可進行受力分析,合力為0者為非極性分子。如:
同種原子組成的雙原子分子都是非極性分子。
高中階段知道以下的就夠了:
極性分子:,
非極性分子:汽油(混合物,嚴格來說不是)
對於AnBm型,若A化合價的絕對值等於主族數,則為非極性。