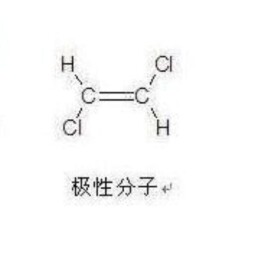
極性分子
化學學科術語之一
極性分子是在以極性共價鍵結合的分子中,正、負電荷中心不重合而形成偶極的分子。分子中正負電荷中心不重合,從整個分子來看,電荷的分佈是不均勻的,不對稱的,這樣的分子為極性分子,以極性鍵結合的雙原子分子一定為極性分子,極性鍵結合的多原子分子視結構情況而定如CH4就是非極性分子。
目錄

極性分子
如:氨氣分子,分子等。
區分極性分子和 非極性分子的方法:分子內部的電荷分佈是否均勻
1、中心原子化合價法組成為型 化合物,若中心原子A的化合價等於族的序數,則該化合物為非極性分子。如:.
2、受力分析法若已知鍵角(或空間結構),可進行受力分析,合力為0者為非極性分子。如:
3、非極性分子同種原子組成的雙原子分子都是非極性分子。不是非極性分子的就是極性分子。高中階段知識如下:極性分子:
簡單判斷方法 對於型 若A化合價等於主族數 則為非極性. 有機極性判斷弱極矩μ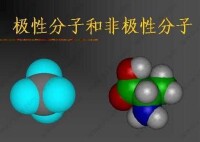 有機化合物大多難溶於水,易溶於汽油、苯、酒精等有機溶劑。原因何在?中學課本、大學課本均對此進行了解釋。儘管措詞不同,但中心內容不外乎是:有機化合物一般是非極性或弱極性的,它們難溶於極性較強的水,易溶於非極性的汽油或弱極性的酒精等有機溶劑。汽油的極性在課本中均未做詳細說明,故而在教學中常常做如下解釋:所有的烷烴,由於其中的σ鍵的極性極小,以及結構是對稱的,所以其分子的偶極矩為零,它是一非極性分子。烷烴易溶於非極性溶劑,如碳氫化合物、四氯化碳等。以烷烴為主要成分的汽油也就不具有極性了。確切而言,上述說法是不夠嚴格的。我們知道,分子的極性(永久烷極)是由其中正、負電荷的“重心”是否重合所引起的。根據其分子在空間是否絕對對稱來判定極性,化學鍵極性的向量和——弱極矩μ則是其極性大小的客觀標度。分析1常見烷烴中,、分子無極性,是折線型分子,鍵的極性不能相互完全抵消,其。至於其它不含支鏈的烷烴,分子中碳原子數為奇數時,一定不完全對稱而具有極性;分子中碳原子數為偶數時,僅當碳原子為處於同一平面的鋸齒狀排布的反交叉式時,分子中鍵的極性才能相互完全抵消,偶極矩為零,但由於分子中C—C鍵可以旋轉,烷烴分子(除)具有許多構象,而上述極規則的鋸齒狀反交叉式僅是其無數構象“平衡混合物”中的一種,所以,從整體來說,除、 外,不帶支鏈的烷烴均有極性。帶有支鏈的烷烴,也僅有 、 等分子中H原子被—CH3完全取代后的產物 2,2—二甲基丙烷、2,2,3,3—四甲基丁烷等少數分子不顯極性,余者絕大多數都有一定的極性。由於烷烴中碳原子均以雜化方式成鍵,鍵的極性很小,加上其分子中化學鍵的鍵角均接近於,有較好的對稱性(但非絕對對稱)故分子的極性很弱,其偶極矩一般小於0.1D。分析2烷烴中,乙烯分子無極性,丙烯分子,1—丁烯分子均不以雙鍵對稱,μ分別為0.336D、0.34D。2—丁烷,順—2—丁烯的,反—2—丁烯的偶極矩為零,即僅以對稱的反式烯烴分子偶極矩為零(當分子中C原子數≥6時,由於C-Cσ鍵旋轉,產生不同的構象,有可能引起μ的變化),含奇數碳原子的烯烴不可能以絕對對稱,故分子均有極性。二烯烴中,丙二烯(通常不能穩定存在)、1、3一丁二烯分子無極性,1、2一丁二烯分子μ為0.408D,2—甲基一1,3—丁二烯(異戊二烯)分子也為極性分子。炔烴中,乙炔、2—丁炔中C原子均在一條直線上,分子以C—C對稱,無極性,但丙炔、1—丁炔分子不對稱,其極性較大,μ分別為0.78D和0.80D。芳香烴中,苯無極性,甲苯、乙苯有極性,μ分別為0.36D、0.59D;二甲苯中除對二甲苯外的另兩種 同分異構體分子不對稱,為極性分子,顯而易見,三甲苯中之間三甲苯分子的μ為零,聯苯、萘的分子也無極性。結論綜上所述,烴的分子有無極性仍是取決於各自的對稱程度是否將鍵的極性完全抵消。當某分子並不因其中C—Cσ鍵的旋轉而引起碳干排布不同的構象時,構型則絕對對稱,分子無極性。將其分子中H原子全部用所替代,分子的偶極矩仍為零。作為以烷烴為主要成分的汽油、石蠟,其中可能含有非極性的分子構象,但從整體來說,同絕大多數烴的分子一樣,它們也是具有極性的,只是由於其中C—H鍵的極性極弱,其偶極矩極小。烴類的偶極矩一般小於1D,在不飽和烴中尚有以、Sp雜化方式成鍵的碳原子,鍵的極性及分子的極性均較相應的飽和鍵烴強,炔烴的極性較烯烴強。至於烴的衍生物,常見的除四鹵化碳,六鹵乙烷、四鹵乙烷、對二鹵苯、對二硝基苯、間三鹵苯等非極性的烴分子中氫原子或被其它原子或原子團全部或部分以完全對稱的方式所取代的產物等少數物質外,多數都具有極性,分子的偶極矩較相應的烴大,一般大於1D。應用由此可見,有機物的分子除少數為非極性分子外,大多數是具有極性的。其偶極矩不少還比水大,如一氯甲烷為1.87D、一氯乙浣為2.05D、溴苯為1.70D、乙醛為2.69D、丙酮為2.88D、硝基酸為4.22D、乙醇為16.9D,有機物的極性並不都很弱。當然,與無機物相比較,有機物是弱極性,作為常見的有機物之一的汽油,儘管其主要成分的偶極矩不大,在教學中往往將汽油及烷烴等視為非極性的。但烷有烴等有無極性是個是非問題,在教學中尤其在師範院校化學專業的教學中,不宜進行如此處理而不加任何說明。否則,容易引起學生錯覺,往往不加考慮地認為烷及烴的分子都絕對對稱的、均無極性,而將問題簡單化、絕對化、對本身的業務進修及今後的教學工作都會帶來一些不必要的麻煩。所以,不管因為什麼原因在教學中至少都必須明確說明有機物的弱極性與非極性的前提是與無機物整體相比較,汽油等物質因主要成分的極性很弱,通常視為非極性。建議、硝基苯等極性較強,為何它們不溶於水?有些教科書上將相似相溶規律中的相似僅提及溶質、溶劑的極性是很不夠的。儘管溶質溶劑極性的相似是其能否相互溶解的一個重要因素,但並不是唯一的。物質的溶解性還取決於它們分子結構、分子間作用力的類型與大小的相似。例如,水和乙醇可以無限制的相互混溶、煤油與乙醇只是有限度地相互溶解,而水和煤油幾乎完全不相溶。對於這些事實,如果只從分子極性的角度來考慮是難以令人滿意的,但我們可以從分子結構上得到解釋。水和乙醇的分子都是由一個 與一個小的原子或原子團結合而成,其結構很相似,分子間都能形成氫鍵,因此能無限制地相互相混。無疑,隨著醇分子中烴基的增大,它與水分子結構上的相似程度將降低,醇在水中的溶解度也將隨之減小。煤油主要是分子中含有8—16個碳原子的烷烴的混和物,因乙醇分子中含有一個烷烴的烴基,結構上有相似之處,它們能互溶,但乙醇分子中含有一個跟烴基毫不相干的。因此,它們的相互溶解是有一個的限度的。水的分子結構與煤油毫無相似之處,煤油不溶於水、極性較強的 、溴苯、硝基苯不溶於水也就不奇怪了。至於低分子量的羧、酸、醇、醛、酮等易溶於水,則可以從其分子的極性及其分子與水分子能形成氫鍵得到解釋。由此可見,對於相似相溶這條經驗規則的應用,我們應從溶質、溶劑的分子結構、分子間作用力的類型和大小及其偶極矩等多個方面來考慮,忽視哪一點,都可能帶來一些不必要的疑惑,這無論在中學還是大學的教學中都應引起足夠的重視。鍵與分子鍵的極性與分子的極性是兩個不同的概念,極性鍵與極性分子間既有聯繫又有區別。極性分子一定含有極性鍵,即極性鍵是形成極性分子的必要條件,也可能含有非極性鍵。含有極性鍵的分子不一定是極性分子,即極性分子內不僅含極性鍵,而且分子結構不對稱。若分子中的鍵全部是非極性的,這樣的分子一般是非極性分子。常見類型有以下幾種:1.含有極性鍵的非極性分子,如等。2.含有非極性鍵的非極性分子,如等。3.既含極性鍵又含非極性鍵的極性分子,如等。4.既含極性鍵又含非極性鍵的非極性分子,如等。一般從結構和溶解性上可以做出判斷:有暴露的羥基,暴露的羧基,暴露的氨基的物質極性可能很大;然後溶解性實驗,溶劑的極性一般與物質極性一致。看點的擴散,如果點很凝聚,那麼該物質極性可能比溶劑高,隨溶劑擴散那麼極性可能低一些。
有機化合物大多難溶於水,易溶於汽油、苯、酒精等有機溶劑。原因何在?中學課本、大學課本均對此進行了解釋。儘管措詞不同,但中心內容不外乎是:有機化合物一般是非極性或弱極性的,它們難溶於極性較強的水,易溶於非極性的汽油或弱極性的酒精等有機溶劑。汽油的極性在課本中均未做詳細說明,故而在教學中常常做如下解釋:所有的烷烴,由於其中的σ鍵的極性極小,以及結構是對稱的,所以其分子的偶極矩為零,它是一非極性分子。烷烴易溶於非極性溶劑,如碳氫化合物、四氯化碳等。以烷烴為主要成分的汽油也就不具有極性了。確切而言,上述說法是不夠嚴格的。我們知道,分子的極性(永久烷極)是由其中正、負電荷的“重心”是否重合所引起的。根據其分子在空間是否絕對對稱來判定極性,化學鍵極性的向量和——弱極矩μ則是其極性大小的客觀標度。分析1常見烷烴中,、分子無極性,是折線型分子,鍵的極性不能相互完全抵消,其。至於其它不含支鏈的烷烴,分子中碳原子數為奇數時,一定不完全對稱而具有極性;分子中碳原子數為偶數時,僅當碳原子為處於同一平面的鋸齒狀排布的反交叉式時,分子中鍵的極性才能相互完全抵消,偶極矩為零,但由於分子中C—C鍵可以旋轉,烷烴分子(除)具有許多構象,而上述極規則的鋸齒狀反交叉式僅是其無數構象“平衡混合物”中的一種,所以,從整體來說,除、 外,不帶支鏈的烷烴均有極性。帶有支鏈的烷烴,也僅有 、 等分子中H原子被—CH3完全取代后的產物 2,2—二甲基丙烷、2,2,3,3—四甲基丁烷等少數分子不顯極性,余者絕大多數都有一定的極性。由於烷烴中碳原子均以雜化方式成鍵,鍵的極性很小,加上其分子中化學鍵的鍵角均接近於,有較好的對稱性(但非絕對對稱)故分子的極性很弱,其偶極矩一般小於0.1D。分析2烷烴中,乙烯分子無極性,丙烯分子,1—丁烯分子均不以雙鍵對稱,μ分別為0.336D、0.34D。2—丁烷,順—2—丁烯的,反—2—丁烯的偶極矩為零,即僅以對稱的反式烯烴分子偶極矩為零(當分子中C原子數≥6時,由於C-Cσ鍵旋轉,產生不同的構象,有可能引起μ的變化),含奇數碳原子的烯烴不可能以絕對對稱,故分子均有極性。二烯烴中,丙二烯(通常不能穩定存在)、1、3一丁二烯分子無極性,1、2一丁二烯分子μ為0.408D,2—甲基一1,3—丁二烯(異戊二烯)分子也為極性分子。炔烴中,乙炔、2—丁炔中C原子均在一條直線上,分子以C—C對稱,無極性,但丙炔、1—丁炔分子不對稱,其極性較大,μ分別為0.78D和0.80D。芳香烴中,苯無極性,甲苯、乙苯有極性,μ分別為0.36D、0.59D;二甲苯中除對二甲苯外的另兩種 同分異構體分子不對稱,為極性分子,顯而易見,三甲苯中之間三甲苯分子的μ為零,聯苯、萘的分子也無極性。結論綜上所述,烴的分子有無極性仍是取決於各自的對稱程度是否將鍵的極性完全抵消。當某分子並不因其中C—Cσ鍵的旋轉而引起碳干排布不同的構象時,構型則絕對對稱,分子無極性。將其分子中H原子全部用所替代,分子的偶極矩仍為零。作為以烷烴為主要成分的汽油、石蠟,其中可能含有非極性的分子構象,但從整體來說,同絕大多數烴的分子一樣,它們也是具有極性的,只是由於其中C—H鍵的極性極弱,其偶極矩極小。烴類的偶極矩一般小於1D,在不飽和烴中尚有以、Sp雜化方式成鍵的碳原子,鍵的極性及分子的極性均較相應的飽和鍵烴強,炔烴的極性較烯烴強。至於烴的衍生物,常見的除四鹵化碳,六鹵乙烷、四鹵乙烷、對二鹵苯、對二硝基苯、間三鹵苯等非極性的烴分子中氫原子或被其它原子或原子團全部或部分以完全對稱的方式所取代的產物等少數物質外,多數都具有極性,分子的偶極矩較相應的烴大,一般大於1D。應用由此可見,有機物的分子除少數為非極性分子外,大多數是具有極性的。其偶極矩不少還比水大,如一氯甲烷為1.87D、一氯乙浣為2.05D、溴苯為1.70D、乙醛為2.69D、丙酮為2.88D、硝基酸為4.22D、乙醇為16.9D,有機物的極性並不都很弱。當然,與無機物相比較,有機物是弱極性,作為常見的有機物之一的汽油,儘管其主要成分的偶極矩不大,在教學中往往將汽油及烷烴等視為非極性的。但烷有烴等有無極性是個是非問題,在教學中尤其在師範院校化學專業的教學中,不宜進行如此處理而不加任何說明。否則,容易引起學生錯覺,往往不加考慮地認為烷及烴的分子都絕對對稱的、均無極性,而將問題簡單化、絕對化、對本身的業務進修及今後的教學工作都會帶來一些不必要的麻煩。所以,不管因為什麼原因在教學中至少都必須明確說明有機物的弱極性與非極性的前提是與無機物整體相比較,汽油等物質因主要成分的極性很弱,通常視為非極性。建議、硝基苯等極性較強,為何它們不溶於水?有些教科書上將相似相溶規律中的相似僅提及溶質、溶劑的極性是很不夠的。儘管溶質溶劑極性的相似是其能否相互溶解的一個重要因素,但並不是唯一的。物質的溶解性還取決於它們分子結構、分子間作用力的類型與大小的相似。例如,水和乙醇可以無限制的相互混溶、煤油與乙醇只是有限度地相互溶解,而水和煤油幾乎完全不相溶。對於這些事實,如果只從分子極性的角度來考慮是難以令人滿意的,但我們可以從分子結構上得到解釋。水和乙醇的分子都是由一個 與一個小的原子或原子團結合而成,其結構很相似,分子間都能形成氫鍵,因此能無限制地相互相混。無疑,隨著醇分子中烴基的增大,它與水分子結構上的相似程度將降低,醇在水中的溶解度也將隨之減小。煤油主要是分子中含有8—16個碳原子的烷烴的混和物,因乙醇分子中含有一個烷烴的烴基,結構上有相似之處,它們能互溶,但乙醇分子中含有一個跟烴基毫不相干的。因此,它們的相互溶解是有一個的限度的。水的分子結構與煤油毫無相似之處,煤油不溶於水、極性較強的 、溴苯、硝基苯不溶於水也就不奇怪了。至於低分子量的羧、酸、醇、醛、酮等易溶於水,則可以從其分子的極性及其分子與水分子能形成氫鍵得到解釋。由此可見,對於相似相溶這條經驗規則的應用,我們應從溶質、溶劑的分子結構、分子間作用力的類型和大小及其偶極矩等多個方面來考慮,忽視哪一點,都可能帶來一些不必要的疑惑,這無論在中學還是大學的教學中都應引起足夠的重視。鍵與分子鍵的極性與分子的極性是兩個不同的概念,極性鍵與極性分子間既有聯繫又有區別。極性分子一定含有極性鍵,即極性鍵是形成極性分子的必要條件,也可能含有非極性鍵。含有極性鍵的分子不一定是極性分子,即極性分子內不僅含極性鍵,而且分子結構不對稱。若分子中的鍵全部是非極性的,這樣的分子一般是非極性分子。常見類型有以下幾種:1.含有極性鍵的非極性分子,如等。2.含有非極性鍵的非極性分子,如等。3.既含極性鍵又含非極性鍵的極性分子,如等。4.既含極性鍵又含非極性鍵的非極性分子,如等。一般從結構和溶解性上可以做出判斷:有暴露的羥基,暴露的羧基,暴露的氨基的物質極性可能很大;然後溶解性實驗,溶劑的極性一般與物質極性一致。看點的擴散,如果點很凝聚,那麼該物質極性可能比溶劑高,隨溶劑擴散那麼極性可能低一些。

極性分子