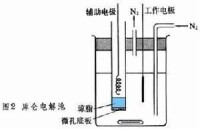
庫侖滴定法
庫侖滴定法
又稱恆電流庫侖滴定法,是建立在控制電流電解過程基礎上的庫侖分析法。
強恆流電解池,同時用電鐘記錄時間。由於電極反應,在工作電極附近不斷產生一種物質,它與溶液中被測物質發生反應。當被測定物質被“滴定”(反應)完了以後,由指示反應終點的儀器發出訊號,立即停止電解,關掉電鐘。按照法拉第電解定律,可由電解時間 t和電流強度 i計算溶液中被測物質的質量 W:
庫侖滴定法
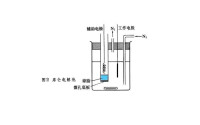
圖1
負極:2H++2e─→H2 正極:2Br-─→Br2+2e
電極上產生的Br2與溶液中的肼起反應:
NH2—NH2+2Br2─→N2+4HBr
過量的Br2將指示劑氧化使之褪色,指示終點。停止電解,從電流和時間計算溶液中肼的含量。
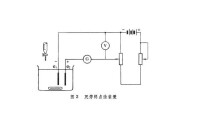
電位法 測定溶液中酸的濃度時,用玻璃電極和甘汞電極為指示電極,用pH計指示終點。鉑負極為工作電極,銀正極為輔助電極。電極反應為:
正極:2H++2e─→H2
負極:2Ag+2Cl-─→2AgCl+2e
隨著電解的進行,溶液中的酸度不斷降低。用pH計上pH的突然升高指示終點。利用這個原理可測定中和法的基準物質鄰苯二甲酸氫鉀的純度,精密度達到百分之幾。
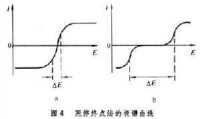
圖4
利用死停終點法指示庫侖滴定終點的例子是用電解產生的 Br2來滴定As(Ⅲ)。這時庫侖電解池的兩個工作電極都是鉑電極。在含As(Ⅲ)的溶液中加入溴化鈉和硫酸,電極上的反應為:
負極:2H++2e─→H2
正極:2Br-─→Br2+e
兩個指示電極e1、e2及其線路見圖3。鉑正級上電解產生的Br2滴定溶液中的As(Ⅲ)。檢流計G指示終點。
庫侖滴定是目前最準確的常量分析方法,又是高度靈敏的痕量成分測定方法。由於時間和電流都可準確地測量,庫侖滴定的精密度是很高的,常量成分測定的精密度可望達到二十萬分之幾。該法在它能夠應用的場合,比一般容量分析優越。它不需要製備標準溶液,因而不存在標準溶液的穩定性問題。它不需要測量體積,也不存在這方面的誤差。它比一般常量方法更容易自動化。在庫侖電解池中,通過電解產生的滴定劑有:H+、 OH-、Cl2、Br2、I2、 Ce(Ⅳ)、Ti(Ⅲ)、 Fe(Ⅱ)、Mn(Ⅱ)、Ag(Ⅰ)、Fe(CN)咶、Fe(CN)忹、CuBr娛、 Sn(Ⅱ)等。它們可滴定很多無機和有機物質。庫侖滴定最適合於分析那些在容量分析中用作基本標準的化學試劑。