石墨結構
礦物質石墨的晶體結構
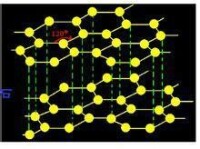
石墨分子結構
石墨與金剛石、碳60、碳納米管等都是碳元素的單質,它們互為同素異形體。六個碳原子在同一個平面上形成了正六連連形的環,伸展成片層結構,這裡C-C鍵的鍵長皆為142pm,這正好屬於原子晶體的鍵長範圍,因此對於同一層來說,它是原子晶體。在同一平面的碳原子還各剩下一個p軌道,它們相互重疊。電子比較自由,相當於金屬中的自由電子,所以石墨能導熱和導電,這正是金屬晶體特徵。因此也歸類於金屬晶體。
石墨晶體中層與層之間相隔340pm,距離較大,是以范德華力結合起來的,即層與層之間屬於分子晶體。但是,由於同一平面層上的碳原子間結合很強,極難破壞,所以石墨的溶點也很高,化學性質也穩定。
鑒於它的特殊的成鍵方式,不能單一的認為是單晶體或者是多晶體,現在普遍認為石墨是一種混合晶體。
常溫下單質碳的化學性質比較穩定,不溶於水、稀酸、稀鹼和有機溶劑;不同高溫下與氧反應燃燒,生成二氧化碳或一氧化碳;在鹵素中只有氟能與單質碳直接反應;在加熱下,單質碳較易被酸氧化;在高溫下,碳還能與許多金屬反應,生成金屬碳化物。碳具有還原性,在高溫下可以冶鍊金屬。
石墨質軟,黑灰色;有油膩感,可污染紙張。硬度為1~2,沿垂直方向隨雜質的增加其硬度可增至3~5。比重為1.9~2.3。比表面積範圍集中在1-20m2/g,在隔絕氧氣條件下,其熔點在3000℃以上,是最耐溫的礦物之一。它能導電、導熱。
自然界中純凈的石墨是沒有的,其中往往含有SiO、AlO、FeO、CaO、PO、CuO等雜質。這些雜質常以石英、黃鐵礦、碳酸鹽等礦物形式出現。此外,還有水、瀝青、CO、H、CH、N等氣體部分。因此對石墨的分析,除測定固定碳含量外,還必須同時測定揮發分和灰分的含量。
石墨與金剛石、碳60、碳納米管、石墨烯等都是碳元素的單質,它們互為同素異形體。
石墨由於其特殊結構,而具有如下特殊性質:
1、耐高溫性:石墨的熔點為3850±50℃,沸點為4250℃,即使經超高溫電弧灼燒,重量的損失很小,熱膨脹係數也很小。石墨強度隨溫度提高而加強,在2000℃時,石墨強度提高一倍。
2、導電、導熱性:石墨的導電性比一般非金屬礦高一百倍。導熱性超過鋼、鐵、鉛等金屬材料。導熱係數隨溫度升高而降低,甚至在極高的溫度下,石墨成絕熱體。石墨能夠導電是因為石墨中每個碳原子與其他碳原子只形成3個共價鍵,每個碳原子仍然保留1個自由電子來傳輸電荷。
3、潤滑性:石墨的潤滑性能取決於石墨鱗片的大小,鱗片越大,摩擦係數越小,潤滑性能越好。
4、化學穩定性:石墨在常溫下有良好的化學穩定性,能耐酸、耐鹼和耐有機溶劑的腐蝕。
5、可塑性:石墨的韌性好,可碾成很薄的薄片。
6、抗熱震性:石墨在常溫下使用時能經受住溫度的劇烈變化而不致破壞,溫度突變時,石墨的體積變化不大,不會產生裂紋。
石墨的工藝特性主要決定於它的結晶形態。結晶形態不同的石墨礦物,具有不同的工業價值和用途。工業上,根據結晶形態不同,將天然石墨分為三類。
1、緻密結晶狀石墨
緻密結晶狀石墨又叫塊狀石墨。此類石墨結晶明顯晶體肉眼可見。顆粒直徑大於0.1毫米,比表面積範圍集中在0.1-1m/g,晶體排列雜亂無章,呈緻密塊狀構造。這種:石墨的特點是品位很高,一般含碳量為60~65%,有時達80~98%,但其可塑性和滑膩性不如鱗片石墨好。
2、鱗片石墨
石墨晶體呈鱗片狀;這是在高強度的壓力下變質而成的,有大鱗片和細鱗片之分。此類石墨礦石的特點是品位不高,一般在2~3%,或10~25%之間。是自然界中可浮性最好的礦石之一,經過多磨多選可得高品位石墨精礦。這類石墨的可浮性、潤滑性、可塑性均比其他類型石墨優越;因此它的工業價值最大。
3、隱晶質石墨
隱晶質石墨又稱微晶石墨或土狀石墨,這種石墨的晶體直徑一般小於1微米,比表面積範圍集中在1-5m/g,是微晶石墨的集合體,只有在電子顯微鏡下才能見到晶形。此類石墨的特點是表面呈土狀,缺乏光澤,潤滑性比鱗片石墨稍差。品位較高。一般的60~85%。少數高達90%以上。一般應用於鑄造行業比較多。主要蘊藏在湖南郴州魯塘。隨這石墨提純技術的提高。土狀石墨應用越來越廣泛。
