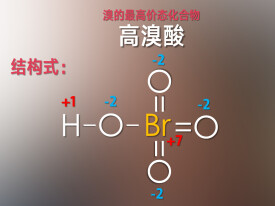
高溴酸
溴的最高價化合物
高溴酸是溴的最高價化合物,具有極強的酸性和氧化性。
SeO→BrO+β(t=22.5min)
BrO→Kr+2O+β(t=2.39h)
後來發現可通過化學反應製備,用氟氣或二氟化氙氧化溴酸鹽得到,反應式如下:
NaBrO+XeF+H0=NaBrO+2HF+Xe(產率10%)
然後酸化就可以了,這兩種方法產率都較低,因為二氟化氙和氟氣遇水也會分解干擾反應進行,因此得到的只是含有少量高溴酸根的溶液。由於高溴酸根濃度一高就會自動分解,所以不存在高溴酸分子。
高溴酸(實際是高溴酸鹽和稀硫酸的混合液)是強酸,酸性接近高氯酸,具有很強烈的腐蝕性,是強氧化劑,其氧化還原電位為1.76,居鹵族元素含氧酸首位,它容易分解,高溴酸根濃度在超過55%時會自動分解,產物為溴酸和氧氣:2HBrO=2HBrO+O↑
例如:
AgO+2HBrO=2AgBrO+HO
NaOH+2HBrO=NaBrO+HO
Co(OH)+2HBrO=Co(BrO)+2HO
2FeO+7HBrO=2Fe(BrO)+HBrO+3HO
2MnO+5HBrO+HO=2HMnO+5HBrO
稀的高溴酸可以緩慢氧化溴離子和碘離子;濃熱的高溴酸可以將氯離子氧化,將Mn氧化為MnO(也就是將錳元素從+2價氧化成+7價),受熱的溫度不能超過100度,否則會迅速分解。低濃度的高溴酸比較穩定,但在攝氏100度以上也開始分解。
高溴酸的重要鹽類有高溴酸鉀和高溴酸銨(均只存在於溶液中)。由於高溴酸不容易製取,性質不太穩定,關於它的研究不多,用途也不多。