珠蛋白
珠蛋白
珠蛋白是一類能夠通過鐵卟啉環可逆性結合氧的呼吸性蛋白質,廣泛存在於細菌、真菌、植物和動物體內,並顯示出巨大的結構和功能多樣性。珠蛋白與貧血病關係密切,珠蛋白生成障礙貧血(thalassem ia, 簡稱地貧)徠為一組遺傳性血液病,就是由於珠蛋白基因突變或缺失造成的溶血性貧血,目前尚無經濟簡單有效的治療方法,預防控制地貧嬰兒出生是最佳措施。
珠蛋白(英文名為“globin”)是具有攜帶氧能力的蛋白質。在脊椎動物體內有兩種類型:即存在於血液中的血紅蛋白和肌肉中的肌紅蛋白。
目前在神經系統又發現了第三種珠蛋白,主要存在於大腦中,因此被稱之為“神經珠蛋白”。
目前在脊椎動物體內已有4種類型的血紅蛋白被鑒定和正式命名:血紅蛋白(haemoglobin, Hb),肌紅蛋白(myoglobin, Mb),腦紅蛋白(neuroglobin, Ngb)和細胞珠蛋白(cytoglobin, Cygb),共同組成“珠蛋白超家族(globinsuperfamily)” 。
珠蛋白
在脊椎動物,Hb主要分佈於紅細胞內;Mb主要分佈於心肌和骨骼肌細胞,定位於胞質;Ngb主要分佈於神經細胞中,在視網膜、睾丸及某些內分泌組織細胞中亦有分佈,主要定位於胞質;Cygb主要分佈於結締組織成纖維細胞、肝星形細胞、成軟骨細胞和成骨細胞,定位於胞質,Cygb亦分佈於神經系統的某些特殊神經細胞亞群及視網膜的某些特殊類型細胞內,且定位於胞質和細胞核中。
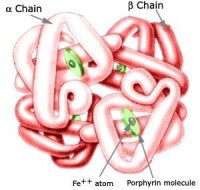
Hb和Mb為經典的攜氧珠蛋白。血紅蛋白是紅細胞內運輸氧的特殊蛋白質,是使血液呈紅色的蛋白,由珠蛋白和血紅素組成,其珠蛋白部分是由兩對不同的珠蛋白鏈(α鏈和β鏈)組成的四聚體。每條多肽鏈各與1個血紅素相連接,4個亞單位之間和亞單位內部由鹽鍵連接;Hb與O2 的結合或解離可影響鹽鍵的形成或斷裂,從而使其四級結構的構型發生改變,導致與O2的親和力隨之改變。Mb是只有三級結構的單鏈蛋白質,與Hb各亞基的三級結構極為相似。Ngb和Cygb亦擁有經典的“ three-over-three”α-螺旋三明治摺疊結構,對攜氧珠蛋白結構和功能有重要作用的PheCD1、HisE7 和HisF8 等關鍵氨基酸殘基,在Ngb和Cygb依然存在。Hb和Mb的血紅素輔基(鐵卟啉化合物)由4個吡咯環通過4個甲炔基相連形成環形, Fe2+居於環中,Fe2 +的6個配位鍵中有4個與吡咯環的N配位結合,1個與近端的HisF8結合,第6個用來結合O2 等外源性配體,該配體同時以氫鍵與遠端的HisE7結合,未結合配體時該配位鍵是空的,故生理狀態下Hb和Mb的血紅素-鐵是“五配位”形式。但Ngb和Cygb的HisE7卻直接與血紅素-鐵第6個配位鍵結合而形成“六配位”形式。
血紅蛋白與肌紅蛋白
氧氣的輸送與貯存以及二氧化碳的運輸是動物體內一項十分重要的生物學功能。它分別由血液中的Hb和肌肉組織中的Mb完成,二者密切相關。首先,Hb將O2結合到它的F( Il )上,並從肺部將O2運送到肌肉組織,在那裡將02傳遞給Mb分子貯存起來,留供機體新陳代謝的需要。其後,Hb用某些氨基結合CO:並將它們帶回肺部。Hb和Mb的氧載體功能是由於血紅素中的亞鐵與氧分子的可逆配位作用。
腦紅蛋白與細胞珠蛋白
Ngb和Cygb的生物學功能目前並不完全清楚,可能的功能主要有:①在氧代謝方面有類似Mb的功能,儲存O2和促進O2向線粒體擴散。Ngb的氧結合動力學參數和它在神經細胞及內分泌細胞的表達水平表明Ngb可能有氧供功能。Ngb在腦內不同區域的表達程度與對缺血缺氧的耐受程度呈正相關, Ngb在缺血缺氧狀態下表達增加,且Ngb過度表達能夠使培養的神經元在缺氧的情況下存活率升高和急性缺血狀態下大鼠腦梗死體積縮小等,都提示Ngb在腦缺血缺氧性損傷中對神經元有保護作用。缺氧條件下Cygb亦表達上調,表明Cygb也可能有類似的功能。②O2感受器功能。結合配體時六配位珠蛋白血紅素袋的構象變化較大,提示Ngb和Cygb可能作為O2感受器,根據O2濃度的變化參與細胞內信號傳導通路調節。③NADH氧化酶作用, 在半缺氧條件下促進糖酵解,產生ATP供能。Cygb亦可能具有過氧化氫酶活性。④作為活性氧和NO基團的清道夫, 以清除組織缺血再灌注時產生的毒性物質。⑤參與膠原合成。NIH 3T3成纖維細胞轉染Cygb基因后,TGFβ誘導膠原α1(I)合成從,而膠原合成增多,提示Cygb與膠原合成有關。
蛋白生成障礙貧血(thalassem ia, 簡稱地貧)為一組遺傳性血液病,是由於珠蛋白基因突變或缺失造成一種或一種以上珠蛋白肽鏈合成減少或完全受抑制,導致構成血紅蛋白(Hb)珠蛋白肽鏈比例失衡而引起慢性進行性溶血性貧血。該病是世界上最常見遺傳病之一,主要流行於地中海沿岸國家、中近東地區、東南亞和印度次大陸等。我國長江以南各省區亦為高發區,廣東、廣西、海南等省區發病率甚高,最高可達15%以上。根據發生缺陷珠蛋白基因的不同,分為α-、β -、δβ -地貧等類型, 其中α-和β -地貧最常見。
α-和β -地貧病理生理中心環節是構成Hb的α-和β -珠蛋白肽鏈之間比例失衡。相對過剩珠蛋白鏈聚合形成包涵體或異常Hb,由此導致紅細胞變形能力下降,攜氧能力改變,紅細胞凋亡加速、無效造血, 血管外溶血增加,紅細胞膜氧化損傷等,使紅細胞成減少、壽命縮短、破壞過多而造成貧血。由於貧血及組織缺氧,骨髓代償性增生導致骨骼變形,同時髓外造血造血能力增加患者出現肝脾大;貧血還促使腸道對鐵吸收的增加,加上嚴重貧血患者反覆輸血,最終體內鐵負荷增加,鐵沉積於心、肝、胰腺、垂體、性腺等器官,通過細胞氧化損傷機制,引起心肌損害、肝損害、激素分泌異常等一系列合併症。
地貧的高發生率和臨床的嚴重性給家庭和社會帶來沉重的負擔,目前尚無經濟簡單有效的治療方法,預防控制地貧嬰兒出生是最佳措施,開展地貧知識宣傳教育,對高發區人群進行群體篩查、婚前檢查、指導合理婚配和遺傳諮詢,普及防治知識,並通過婚前、孕期或對於重型地貧高危胎兒進行產前基因診斷,阻止重型地貧患兒出生。這些措施可有效降低地貧發病率。