酸鹼度
水溶液的酸鹼性強弱程度
酸鹼度描述的是水溶液的酸鹼性強弱程度,用pH來表示。熱力學標準狀況時,pH=7的水溶液呈中性,pH<7者顯酸性,pH>7者顯鹼性。
pH範圍在0~14之間,只適用於稀溶液,氫離子濃度或氫氧根離子濃度大於1mol/L的溶液的酸鹼度直接用濃度表示。
pH,亦稱 氫離子濃度指數、酸鹼值,是溶液中氫離子活度的一種標度,也就是通常意義上溶液酸鹼程度的衡量標準。這個概念是1909年由丹麥生物化學家Søren Peter Lauritz Sørensen提出。p代表德語 Potenz,意思是力量或濃度,H代表氫離子(H)。pH在拉丁文中是 pondus hydrogenii。
pH的定義式為:
其中(此為簡寫,實際上應是,水合氫離子活度)指的是溶液中氫離子的活度(稀溶液下可近似按濃度處理),單位為mol·L 。
298K時,當pH<7的時候,溶液呈酸性,當pH>7的時候,溶液呈鹼性,當pH=7的時候,溶液為中性。水溶液的酸鹼性亦可用pOH衡量,即氫氧根離子的負對數,由於水中存在自偶電離平衡,298K時,pH + pOH = 14。
pH小於7說明的濃度大於的濃度,故溶液酸性強,而pH大於7則說明的濃度小於的濃度,故溶液鹼性強。所以pH愈小,溶液的酸性愈強;pH愈大,溶液的鹼性也就愈強。
在非水溶液或非標準溫度和壓力的條件下,pH=7可能並不代表溶液呈中性,這需要通過計算該溶劑在這種條件下的電離常數來決定pH為中性的值。如373K(100℃)的溫度下,中性溶液的pH ≈ 6。
另外需要注意的是,pH的有效數字是從小數點后開始記錄的,小數點前的部分為指數,不能記作有效數字。
1.在待測溶液中加入pH指示劑,不同的指示劑根據不同的pH值會變化顏色,
例如:
(1)將酸性溶液滴入石蕊試液,則石蕊試液將變紅;將鹼性溶液滴進石蕊試液,則石蕊試液將變藍(石蕊試液遇中性液體不變色)。根據指示劑的研究就可以確定pH的範圍。
(2)將無色酚酞溶液滴入酸性或中性溶液,顏色不會變化;將無色酚酞溶液滴入鹼性溶液,溶液變紅。
註:在有色待測溶液中加入ph指示劑時,應選擇能產生明顯色差的ph指示劑。
2.滴定時,可以作精確的pH標準。
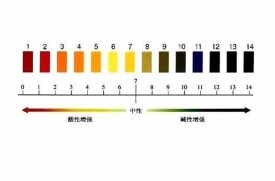
3.使用pH試紙,pH試紙有廣泛試紙和精密試紙,用玻棒蘸一點待測溶液到試紙上,然後根據試紙的顏色變化並對照比色卡也可以得到溶液的pH值。上方的表格就相當於一張比色卡。
4.使用pH計,pH計是一種測量溶液pH的儀器,它通過pH選擇電極(如玻璃電極)來測量出溶液的pH。pH計可以精確到小數點后兩位。
正常情況:新生兒 出生后立即7.11~7.36 5~10分 7.09~7.30 30分 7.21~7.38 >1小時7.26~7.49 1天7.29~7.45 其後7.35~7.45 (濃度36~44nmol/L)
增加:代謝性鹼中毒:應用過多鹼性液體,胃酸丟失(嘔吐或胃管引流),缺鉀(應用大劑量利尿葯及糖皮質類固醇激素,腹瀉,禁食等),糖原累積病等。
呼吸性鹼中毒:過度換氣,腦損傷,高熱,水楊酸類中毒,人工呼吸機通氣量過大等。
呼吸性酸中毒:肺心病,呼吸衰竭,肺水腫等。
身體的酸鹼度:表示血液酸鹼度。
身體大於 3.694 表示偏向鹼性,身體容易引起痛楚;
低於 3.156 則偏向酸性,身體容易引起致慢性病,並可能會出現以下癥狀:
1.容易疲倦,氣喘,貪睡。
2.易感冒或有糖尿病,高血壓及痛風。
3.易肥胖。
4.皮膚多皺紋,無光澤。
人體內由三種機制來調節 PH 值:
1.血液中的蛋白質
2.肺部把二氧化碳排出,防止碳酸積聚。
3.腎臟來排泄酸鹼,併產生 中和 離子調節 PH。
造成酸性體質有兩個主因:
1.情緒壓力大。
2.攝取過量酸性食物。