ivd
體外診斷產品
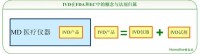
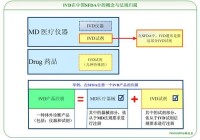
在國際上,IVD作為醫療器械的一個獨立分支,擁有其特有的界定和法規監管體系,特別是美國食品藥品監督管理局(FDA)與歐盟(CE)。IVD主要包括用於體外診斷的儀器、試劑或系統。但在中國情況卻不同,IVD未被獨立區分與界定,即沒有IVD的概念。而國際上通常的IVD概念所包括的產品被打散,分別從屬於醫療器械(Medical Devices,MD)、體外診斷試劑(IVD Reagents)以及藥品中。
醫療器械的定義在我國國務院2000年276號文《醫療器械監督管理條例》規定。醫療器械是指單獨或者組合使用於人體的儀器、設備、器具、材料或者其他物品,包括所需要的軟體;其用於人體體表及體內的作用不是用藥理學、免疫學或者代謝的手段獲得,但是可能有這些手段參與並起一定的輔助作用;其使用旨在達到下列預期目的:
(一)對疾病的預防、診斷、治療、監護、緩解;
(二)對損傷或者殘疾的診斷、治療、監護、緩解、補償;
(三)對解剖或者生理過程的研究、替代、調節;
(四)妊娠控制。
並且規定對醫療器械實行分類管理。根據風險以及採取的措施分為三級,由低到高為:
第一類是指,通過常規管理足以保證其安全性、有效性的醫療器械。
第二類是指,對其安全性、有效性應當加以控制的醫療器械。
第三類是指,植入人體;用於支持、維持生命;對人體具有潛在危險,對其安全性、有效性必須嚴格控制的醫療器械。
但是依據實際需要,又將IVD試劑單獨界定、獨立管理。並於2007年4至5月出台了從質量管理、生產、產品註冊到經營的一系列法規與規則。對體外診斷試劑的定義在2007年6月1日起實施的《體外診斷試劑註冊管理辦法(試行)》中有明確規定,即體外診斷試劑是指按醫療器械管理的體外診斷試劑,包括可單獨使用或與儀器、器具、設備或系統組合使用,在疾病的預防、診斷、治療監測、預后觀察、健康狀態評價以及遺傳性疾病的預測過程中,用於對人體樣本(各種體液、細胞、組織樣本等)進行體外檢測的試劑、試劑盒、校準品(物)、質控品(物)等。
同時明確了根據產品風險程度的高低,體外診斷試劑依次分為三、二、一類,並列舉了部分試劑的分類。
因此在我國,IVD遵從MD的全套法規與規則的要求,並無專門針對性的特有法規。但是IVD試劑則被單獨界定,在遵從MD全套法規的同時,還要遵從其特有的規章要求。比如一個由儀器與試劑構成的體外診斷檢測系統的上市產品註冊,既需要依據醫療器械的註冊管理辦法申請IVD產品中儀器的產品註冊,又需要依據體外診斷試劑註冊管理辦法的規定申請IVD產品中試劑的產品註冊,即最終需要依據兩套要求獲得兩個產品的註冊證。
IVD中國(圖2)
1)重要性:
中國市場實行許可准入制度,其最高監管機關為中國國家藥品監督管理局(以下簡稱為“NMPA”),並且NMPA還是進口IVD產品註冊許可的直接辦理管理機關。通過NMPA的許可是任何進口IVD產品進入中國市場的必需手續,也是唯一通道。正因如此,及時獲得和跟蹤NMPA發布的法規信息,對所有試圖進入或已經進入中國大陸市場的IVD產品生產與經營企業至關重要。
2)獨特性:
NMPA對IVD產品的監管,依據實際需要,區別於FDA和EC,而自成體系。並且,自2007年6月1日起NMPA對IVD試劑的管理脫離了MD的監管體系,進行單獨監管,整個體系處於快速發展的調整階段。因此,對於IVD產品相關企業,尤其是產品已經或意欲進入中國的國外企業,了解和熟悉相關監管法規的難度大大增加。
3)複雜性:
NMPA發布的法規一般是採用針對管理對象的單獨規定。對內容修改進行時一般採用覆蓋、解釋或補充說明的形式發布新的規定,並不提供匯總版本。所以法規信息相對複雜和較為分散。加之目前IVD法規信息甚至MD都處於不斷的變化調整之中,很多法案還處於討論階段,這更加增加了複雜的程度。一般非專門人員不經一定時間和投入一定精力不容易準確找到所需信息,給工作帶來較大的困難,甚至阻礙業務的開展。
4)語言障礙:
對於IVD相關的法規與規章等信息,NMPA只提供中文信息,並不提供任何外文信息的支持。並且從目前看,也沒有其他組織或企業提供這方面的支持。即使採用翻譯,熟悉和了解IVD的相關法規也存在很多的困難。另外NMPA的相關法規專業性很強,不僅僅需要語言方面還需要專業方面的水平,才能使得翻譯更準確和標準化,且通俗易懂。
由於在中國IVD產品沒有單獨分類界定,因此缺乏相應的市場數據進行參考。但是可以參考中國的整個經濟、醫療衛生政策與規模以及醫療器械行業的相關數據進行測算。
1)中國的經濟:
2)中國的醫療衛生規模與政策:
根據衛生部的統計,2008年中國醫療衛生市場規模超過10,000億元人民幣,佔GDP的5.5%,其他歐美國家都在8%~10%之間,而美國這一比例高達15.5%。如果按照本世紀的前10年中國醫療衛生市場年均超過10%的速度,預計到2020年,中國將會成為全球僅次於美國的第二大醫療市場。
同時中國政府大力推行醫療衛生體制改革。2009年4月經國務院召開常務會議審議通過的《關於深化醫藥衛生體制改革的意見》和《2009-2011年深化醫藥衛生體制改革實施方案》正式頒布。至此,中國的醫療衛生體制改革全面啟動。新醫改指出:
a)在2009-2011的3年內政府預計投入8500億元,即每年2800億元。衛生部陳竺部長指出:“今後三年如果每年政府再投入2800億,它是增強,它是在原來基礎上,原來政府已經投入,去年接近2400多億,加上2800億就會超過5000億了。”這些投入將主要用於醫療保障、國家基本藥物制度、醫療服務、公共醫療衛生以及公立醫院的改革上的投資,這幾個方面將使中國醫療系統和觀念實現從“重治療”到“重預防”的轉變。並為醫療領域重要診療手段的醫療器械行業的發展提供了巨大的推動力。
b)在2009-2011的3年使城鄉居民基本醫療保障制度的覆蓋要將達到90%以上。依據世界銀行2008年中國人口的數據13.3億推算,到2011年中國的醫療衛生體系將覆蓋約12億人口。
醫療器械作為現代科學技術產品已廣泛用於疾病預防、診斷、治療、保健和康復過程中,成為現代醫學領域中的重要診療手段。這點已經在中國被廣泛認識,並被遵循佐證的醫療原則所倡導。中國政府更是於2008年將醫療器械與IVD的主管執法機關——國家食品藥品監督管理局(SFDA)併入主管整個醫療衛生的中國衛生部(MOH)之下,以適應整個大衛生的需求。
3)醫療器械市場規模:
目前中國的醫療器械行業同發達國家相比還存在較大差距,但這一市場始終保持著較快的發展速度。自2001年以來,我國醫療器械產業得到長足發展,市場的年增長率高達到了15%~20%。2008年,器械產值達到3000億元規模。受全球金融危機的影響,國際主流醫療器械市場趨於萎縮,而在新醫改政策影響下,中國醫療器械行業的發展空間十分巨大。據預測,未來幾年內中國醫療器械市場規模可能將超過6000億元,或將超過日本成為僅次於美國的全球第二大醫療設備市場。
作為其中的一部分,中國IVD市場無疑是巨大且極富潛力的。而中國IVD市場監管有自身的特點,較之FDA和EC是有著很多區別。對於想以任何方式進入這個市場的每一個企業、組織和人士來說,全面了解中國的IVD與MD的法律法規要求以及實際操作都至關重要。