第VIII族
第VIII族
第VIII族元素在周期系中位置的特殊性是與它們之間性質的類似和遞變關係相聯繫的。在九種元素中,雖然也存在著一般的垂直相似性,如鐵、釕、鋨,但水平相似性如鐵、鈷、鎳則更為突出。因此,為了便於研究,通常把這九種元素分成兩組,把位於第4周期的鐵、鈷、鎳三種元素稱為鐵系元素,其餘六種元素則稱為鉑系元素。由於鑭系收縮的緣故,位於第5周期的釕、銠、鈀與位於第6周期的鋨、銥、鉑非常相似而與第4周期的鐵、鈷、鎳差別較大。鉑系元素被列為稀有元素,和金、銀一起稱為貴金屬。
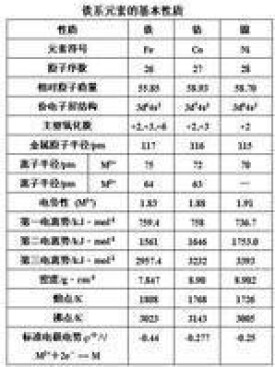
鐵、鈷、鎳三種元素的最外層都有兩個4s電子,只是次外層的3d電子數不同,分別為6、7、8,它們的原子半徑十分相似,所以它們的性質很相似。
由於第一過渡系列元素原子的電子填充過渡到第Ⅷ族時,3d電子已經超過5個,所以它們的價電子全部參加成鍵的可能性減少,因而鐵系元素已經不再呈現出與族數相當的最高氧化態。
一般條件下,鐵的常見氧化態是+2和+3,與強氧化劑作用,鐵可以生成不穩定的+6氧化態的高鐵酸鹽。
一般條件下,鈷和鎳的常見氧化態都是+2,與強氧化劑作用,鈷可以生成不穩定的+3氧化態,而鎳的+3氧化態則少見。
我們從物理性質、化學性質、用途三個方面來介紹鐵系元素的通性。
鐵系元素的原子半徑、離子半徑、電離勢等性質基本上隨原子序數的增加而有規律地變化。但鎳的原子量比鈷小,這是因為鎳的同位素中質量數小的一種占的比例大。
鐵系元素單質都是具有金屬光澤的白色金屬。鈷略帶灰色。它們的密度都比較大,熔點也比較高,它們的熔點隨原子序數的增加而降低,這可能是因為3d軌道中成單電子數按Fe、Co、Ni的順序依次減少(4、3、2),金屬鍵依次減弱的緣故。
鈷比較硬而脆,鐵和鎳卻有很好的延展性。它們都表現有鐵磁性,它們的合金是很好的磁性材料。
鐵系元素電勢圖
由鐵系元素的標準電極電勢看,它們都是中等活潑的金屬。它們的化學性質表現在以下幾個方面:
①在酸性溶液中,Fe、Co和Ni分別是鐵、鈷、鎳離子的最穩定狀態。空氣中的氧能把酸性溶液中的Fe2+氧化成Fe3+2,但是不能氧化Co和Ni成為Co和Ni。
由值看出,高氧化態的鐵(Ⅵ)、鈷(Ⅲ)、鎳(Ⅳ)在酸性溶液中都是很強的氧化劑。
②在鹼性介質中,鐵的最穩定氧化態是+3、而鈷和鎳的最穩定氧化態仍是+2;在鹼性介質中把低氧化態的鐵、鈷、鎳氧化為高氧化態比在酸性介質中容易。低氧化態氫氧化物的還原性按Fe(OH)、Co(OH)、Ni(OH)的順序依次降低。
例如:向Fe的溶液中加入鹼,能生成白色的Fe(OH)的沉澱,但空氣中的氧立即把白色的Fe(OH)氧化成紅棕色的Fe(OH)沉澱:
在同樣條件下生成的粉紅色的Co(OH)則比較穩定,但在空氣中放置,也能緩慢地被空氣中的氧氧化成棕褐色的Co(OH):
而在同樣條件下生成的綠色的Ni(OH)最穩定,根本不能被空氣中的氧所氧化。
由此可見,Fe(OH)的還原性最強,也最不穩定,Ni(OH)的還原性最差,也最穩定。這是由它們在鹼性介質中的標準電極電勢的大小決定的。
③鐵系元素易溶於稀酸中,只有鈷在稀酸中溶解得很慢。它們遇到濃硝酸都呈“鈍態”。鐵能被熱的濃鹼液侵蝕,而鈷和鎳在鹼溶液中的穩定性比鐵高。
④在沒有水汽存在時,一般溫度下,鐵系元素與氧、硫、氯、磷等非金屬幾乎不起作用,但在高溫下卻發生猛烈反應。
鉑系元素都是稀有金屬,它們在地殼中的質量分數估計為:
鉑系元素幾乎完全以單質狀態存在,高度分散在各種礦石中,並共生在一起。
從鉑系元素原子的價電子結構來看,除鋨和銥有2個s原子外,其餘都只有1個s電子或沒有s電子。
形成高氧化態的傾向從左向右(由釕到鈀,由鋨到鉑)逐漸降低。這一點和鐵系元素是一樣的。和其它各副族的情況一樣,鉑系元素的第6周期各元素形成高氧化態的傾向比第5周期相應各元素大。其中只有釕和鋨表現出了與族數相一致的+8氧化態。
我們從物理性質、化學性質兩個方面來介紹鉑系元素的通性。
鉑系元素除鋨呈藍灰色外,其餘都是銀白色的。從金屬單質的密度看,鉑系元素又可分為兩組:第5周期的釕、銠、鈀的密度約為12g·cm,成為輕鉑金屬;第6周期的鋨、銥、鉑的密度約為22g·cm,稱為重鉑金屬。
鉑系元素都是難熔金屬,輕鉑金屬和重鉑金屬的熔、沸點都是從左到右逐漸降低。這六種元素中,最難熔的是鋨,最易熔的是鈀。熔沸點的這種變化趨勢與鐵系金屬相似,這也可能是因為nd軌道中成單電子數從左到右逐漸減少(釕、銠、鈀分別為3、2、0;鋨、銥、鉑分別為4、3、1),金屬鍵逐漸減弱的緣故。
在硬度方面,釕和鋨的特點是硬度高並且脆,因此不能承受機械處理。銠和銥雖可以承受機械處理,但也很困難。鈀和鉑,尤其是鉑,極易承受機械處理,純凈的鉑具有高度的可塑性。將鉑冷軋,可以製得厚度為0.0025mm的箔。
鉑系金屬的化學性質表現在以下幾個方面:
①鉑系金屬對酸的化學穩定性比所有其它各族金屬都高。
釕和鋨,銠和銥對酸的化學穩定性最高,不僅不溶於普通強酸,也不溶於王水中。
鈀和鉑都能溶於王水,鈀還能溶於硝酸(稀硝酸中溶解慢,濃硝酸中溶解快)和熱硫酸中。
②在有氧化劑存在時,鉑系金屬與鹼一起熔融,都可以轉變成可溶性的化合物。
③鉑系金屬不和氮作用。室溫下對空氣、氧等非金屬都是穩定的,不作用。高溫下才能與氧、硫、磷、氟、氯等非金屬作用,生成相應的化合物。
室溫下只有粉狀的鋨在空氣中會慢慢地被氧化,生成揮發性的四氧化鋨OsO,OsO的蒸氣沒有顏色,對呼吸道有劇毒,尤其有害於眼睛,會造成暫時失明。
④鉑系金屬都有一個特性,即很高的催化活性,金屬細粉的催化活性尤其大。
大多數鉑系金屬能吸收氣體,特別是氫氣。鋨吸收氫氣的能力最差,鈀吸收氫氣的能力最強。常溫下,鈀溶解氫的體積比為1:700,在真空中把金屬加熱到373K,溶解的氫就完全放出。氫在鉑中的溶解度很小,但鉑溶解氧的本領比鈀強,鈀吸收氧的體積比為1:0.07,而鉑溶解氧的體積比為1:70。鉑系金屬吸收氣體的性能是與它們的高度催化性能有密切關係的。
⑤鉑系金屬和鐵系金屬一樣,都容易形成配位化合物。
1.鉑的穩定性好,一般做電極、坩堝等,或者跟金銀一樣作為首飾或裝飾品。
2.銥一般可做坩堝,或者特種合金和特種玻璃。
3.鋨是密度最大的金屬,銥鋨按一定比例所制的的合金作為1kg的標準件。
1.ferrous metals:Iron(Ferrum),Cobalt,Nickel
2.Platinium metals:Ruthenium,Rhodium,Palladium
Osmium,Iridium,Platinum
鉑系元素又被稱為稀有元素,它們與金,銀一起又稱為貴金屬(noble metals)
Chapter 19過渡元素(II)
the transition elements(II)
包括:Ferrum Cobalt Nickel
一,General properties
[Ar]3d 4s 它們最外層4S原子軌道上都有二個電子,只是次外層的3d軌道上的電子數分別為6,7,8,而且原子半徑又十分相近,所以它們的性質很相似.
主要是+2,+3氧化態,也有+6氧化態,Co主要是+2,+3氧化態,也有+4,+5氧化態的報導;Ni主要是+2,+3氧化態,也有+4氧化態. Fe Co Ni 的低氧化Oxidation states:
過渡元素(II)的最高氧化數除了Os,Ru形成+8氧化態外,其它各元素的最高氧化記都小於8,這說明過渡元素(II)的d軌道上的電子只能部分參與成鍵.
Fe主要是+2,+3氧化態,也呈現在金屬羰基配合物中出現0價,如Fe(CO),Fe(CO),Co(CO),Ni(CO)
鐵系元素
1)鐵系元素的熔沸點隨原子序數的增加而降低,這可能是因為3d軌道中成單電子數依次減少使金屬鍵減弱的緣故.
2)它們都具有金屬光澤,都是鐵磁性物質.
3)密度隨原子序數的增大而增大,這是由於原子半徑隨原子序數的增大而變小的緣故.
鐵系元素
(1)它們是中等活潑金屬,在通常條件下,無水氣存在時,與非金屬反應不顯著,但在高溫下,與非金屬反應激烈
(2)Reaction with acids
Fe Co Ni 與稀酸反應,但在濃硫酸,濃硝酸中發生鈍化
(3)Reaction with bases
濃鹼緩慢腐蝕Fe;Co,Ni在濃鹼中比較穩定
鐵系元素
(1)Preparation:Fe+5COFe(CO)5
2Co+8CO Co2(CO)8 HCo(CO)4是酸
Ni+4CO Ni(CO)4
150 C-200 C
60 C-80 C
2.5x107 Pa
100~200 C
2.02x107 Pa
Fe 3d64s2 3d8
dsp3雜化:
Co 3d74s2 3d9
(I)式中d2sp3雜化
(II) 式中dsp3雜化
Ni 3d84s2 3d10
sp3雜化
(2)structure
鐵系元素
(3)properties:
a.易分解:Fe(CO)5 Fe+5CO↑用來提純金屬
b.一些其它反應:
在液氨中與Na的反應:Fe(CO)5+2Na=Na2[Fe(CO)4]+CO
在乙醇中與KOH的反應:Fe(CO)5+4KOH=K2Fe(CO)4+K2CO3+2H2O
被I2氧化: Fe(CO)5+I2=Fe(CO)4I2 +CO
被H2還原:Co2(CO)8+H2=2H[Co(CO)4]
(1)Oxides (MO), Hydroxides M(OH)2
FeO(黑色) CoO(灰綠色) NiO(暗綠色)
Fe(OH)2 (白色) Co(OH)2(粉紅色) Ni(OH)2 (蘋果綠色)
微弱兩性(主要鹼性) 兩性 鹼性
O2迅速 O2緩慢 NaOCl強氧化劑
Fe2O3 nH2O(紅棕) Co2O3 nH2O(棕色) Ni2O3 nH2O(黑色)
鐵系元素
(2)salts:
a.CoCl2 6H2O Co2Cl2 2H2O CoCl2 H2O
粉紅色 紫紅色 藍紫色
Co[CoCl4]
藍色
b. MS: M +S =MS (黑色)
新產生的 CoS, NiS 易溶於稀酸,靜止后成為另一種變體,就不易溶解.
c. 2FeSO4 Fe2O3+SO2+SO3
(1) oxides, hydroxide
Fe2O3(磚紅)中等氧化劑 Co2O3(黑)強氧化劑 Ni2O3(黑)強氧化劑
53 C
90 C
120 C
△
2+
2-
鐵系元素
氫氧化鐵有微弱的兩性,只有新沉澱的才能溶於濃鹼中
(2)FeCl3 6H2O :低熔沸點,易溶於有機溶劑,明顯地具有共價性,它可以使蛋白質沉澱,故可作為止血劑.
FeO4 ,其顏色與MnO4 顏色相同
(1)Preparation: Fe2O3+3KNO3+4KOH= 2K2FeO4+3KNO2+2H2O (加熱共融)
2Fe(OH)3+3ClO +4OH =2FeO4 +3Cl +5H2O
(2)Properties: 2FeO4 +10 H+ →2Fe +3/2O2↑+5H2O
a.在酸性介質中,它是強氧化劑,其電極電位介於MnO4和O3 之間:2K2FeO4+2NH3+2H2O=2Fe(OH)3+4KOH+N2
2FeO4+NH4 +8H =2Fe +N2 +8H2O
2-
-
2-
3+
2-
-
-
-
-
2-
+
3+
+
鐵系元素
b. Ba +FeO4 =BaFeO4 (一水合)
(1)K4Fe(CN)6 (黃血鹽), K3Fe(CN)6 (赤血鹽)
a.製備:6KCN+FeS= K4[Fe(CN)6] +K2S
K4Fe(CN)6 +Cl2=K3Fe(CN)6+2KCl
b.性質:
(i)在鹼性溶液中有氧化性:
4K3Fe(CN)6+4KOH = 4K4[Fe(CN)6]+O2↑+2H2O
(ii)在中性溶液中,K3Fe(CN)6有微弱的水解作用,因此配製赤血鹽溶液時,最好臨用時配製.
K3Fe(CN)6 +3H2O Fe(OH)3+3KCN+3HCN
2+
2-
鐵系元素
(iii) Fe3+,Fe2+的鑒別:
經x-射線衍射證明:滕氏藍和普魯士藍是相同的結構,Fe(II) 離子位於立方體的一組四個兩個互不相鄰的頂點,Fe(III)離子位於立方體的另一組四個互不相鄰的頂點,氰根離子位於立方體的十二條棱上:
1/8晶胞
鐵系元素
(2)二茂鐵: (C5H5)2Fe
2C5H5MgBr+FeCl2=(C5H5)2Fe +MgBr2 +MgCl2
(3)Fe(III)的無水鹽能結合氨,生成[Fe(NH3)6],
但溶於水分解.
(4)[Fe(SCN)n] n=1~6 Fe3++SCN =Fe(SCN)
(5)鈷,鎳重要配合物:
a.
3+
3-n
2+
鐵系元素
b.
c.
鉑族元素包括釕(Ru),銠(Rh),鈀(Pd),鋨(Os),銥(Ir),鉑(Pt)六種元素。這六種元素可分成兩組:釕,銠,鈀的比重約為12,稱為輕鉑金屬;鋨,銥,鉑的比重約為22,稱為重鉑金屬.
Electron configuration
從它們的電子構型來盾:ns軌道上除了Os, Ir有兩個電子外,其餘
都只有1或0個電子,這種情況說明鉑系元素原子的價電子有從
ns軌道移到(n-1)d軌道的強烈趨勢,也說明它們的(n-1)d,ns
原子軌道之間的能級間隔小.
Oxidation states:
Ru Rh Pd
+4(+8) +3 +2
Os Ir Pt
+6+8 +3+4 +2,+4
高氧化態穩定性減弱
高氧化態穩定性增強
鉑族元素
Physical properties
(1).顏色:除Os為藍灰色外,其餘都是銀白色
(3).硬度 Ru Rh Pd Os Ir Pt
6.5 – 4.8 7.0 6.5 4.3
(4).延展性:鉑的延展性最好,冷軋可制0.0025mm的箔
Chemical properties:
(1) 化學穩定性特別高
鉑族元素
(2) Reaction with acids
Pd,Pt溶於王水,Pd也可溶於濃HNO3和熱,濃H2SO4中,Pt可溶於HCl—H2O2,HCl-HClO4中,其餘的四種元素,不僅不溶於普通強酸,連王水也不溶
(3) Reaction with bases
所有鉑系金屬在有氧化劑存在時,與鹼一起熔融,成為可溶性化合物,所以白金坩堝(Pt)不能用於NaOH+Na2O2或者Na2CO3+S中使用.
(4) Reaction with non-metals
在常溫下,鉑系元素不與非金屬反應,只有粉狀鋨在室溫下的
空氣中會慢慢地被氧化: Os+2O2=OsO4↑
在高溫下,Pt系元素與S,P,F2,Cl2等非金屬反應,但不與
N2反應
鉑族元素
(5) 鉑系元素的催化活性很高,金屬細粉(鉑黑)的催化活性尤其大.
(6) 大多數的鉑系金屬能吸收氣體,特別是氫氣,Pd吸收氫氣最多,常溫下,1體積的鈀能溶解200體積以上的氫氣,在真空中鈀金屬加熱到200 C,溶解的H2就完全放出來
Pt溶解O2的能力強.1體積Pt能溶解70體積左右的氧,鉑系元素吸收氣體的性質和它們的高度催化性能有密切關係.
鉑族元素
1.[+4]O.S: H2PtCl6, M2PtCl6
製備:
性質:
a. NH4,K,Rb,Cs 的鹽都是黃色八面體晶體,難溶.
b. (NH4)2[PtCl6]熱分解.
(NH4)2[PtCl6] Pt +2NH4Cl+2Cl2
3(NH4)2[PtCl6] 3Pt +2N2+2NH4Cl+16HCl
c. K2[PtCl6]與水作用生成鹼式鹽.
K2[PtCl6] +H2O= K2[PtCl5(OH)]+HCl
d.與還原劑反應, 生成Pt(II)的鹽
K2[PtCl6] +K2C2O4= K2[PtCl4] +2KCl+2CO2
△
△
鉑族元素
e.[PtCl6] 在水中非常穩定,但氯可被 Br,I 取代
穩定性: [PtCl6] <[PtBr6] <[PtI6]
黃色 深紅色 黑色
2.[+2]O.S
(1) Zeise salt: K[Pt(C2H4)Cl3]
[PtCl4] +C2H4= [Pt(C2H4)Cl3] +Cl
2[Pt(C2H4)Cl3]=[Pt(C2H4)Cl2]2+2Cl
(2)PdCl2:
Pd+Cl2=PdCl2
2-
2-
2-
2-
2-
-
-
-
-
-
-
α PdCl2為扁平鏈狀結構
β PdCl2(cluster)