小干擾RNA
小干擾RNA
小干擾RNA(Small interfering RNA;siRNA)有時稱為短干擾RNA(short interfering RNA)或沉默RNA(silencing RNA),是一個長20到25個核苷酸的雙股RNA,在生物學上有許多不同的用途。目前已知siRNA主要參與RNA干擾(RNAi)現象,以帶有專一性的方式調節基因的表達。此外,也參與一些與RNAi相關的反應途徑,例如抗病毒機制或是染色質結構的改變。不過這些複雜機制的反應途徑目前尚未明了。
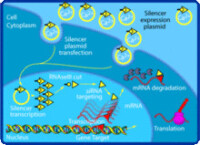
經由siRNA傳達的RNA干擾機制
siRNA通常是一段長21個核苷酸的雙股RNA(dsRNA),其兩股分別在RNA的兩端超出另一端2個核苷酸,圖示如下:
小干擾RNA
小干擾RNA(siRNA),有時稱為短干擾RNA或沉默RNA,是一類雙鏈RNA分子,長度為20-25個鹼基對,類似於miRNA,並且在RNA干擾(RNAi)途徑內操作。它干擾了表達與互補的核苷酸序列的特定基因的轉錄后降解的mRNA,從而防止翻譯。
siRNA由雙鏈RNA (double strand RNA, dsRNA) 在細胞內被RNase III (如Dicer) 切割成21~25bp大小的雙鏈RNA。dsRNA可以是外源的, 如病毒RNA複製中間體或人工導入的dsRNA;也可以是內源的, 如細胞中單鏈RNA在RNA依賴的RNA聚合酶的作用下形成的dsRNA 。
1.長dsRNA(可來自髮夾,互補RNA和RNA依賴性RNA聚合酶)被稱為Dicer的內切核糖核酸酶切割。Dicer切割長dsRNA以形成短干擾RNA或siRNA;這使得分子能夠形成RNA誘導的沉默複合物(RISC)。
2.一旦siRNA進入細胞,它就會被整合到其他蛋白質中以形成RISC。
3.一旦siRNA是RISC複合物的一部分,siRNA就展開以形成單鏈siRNA。
5.作為RISC複合物一部分的單鏈siRNA現在可以掃描並找到互補的mRNA
6.一旦單鏈siRNA(RISC複合物的一部分)與其靶mRNA結合,它就會誘導mRNA切割。
7.現在切割mRNA並被細胞識別為異常。這導致mRNA的降解,並且反過來不將mRNA翻譯成氨基酸然後轉化為蛋白質。從而沉默編碼該mRNA的基因。
siRNA也類似於miRNA,然而,miRNA來自較短的莖環RNA產物,通常通過抑制翻譯來沉默基因,並且具有更廣泛的作用特異性,而siRNA通常通過在翻譯前切割mRNA而起作用,並且具有100%的互補性,因此目標特異性非常嚴格。
通過轉染外源siRNA進行的基因敲低通常是不令人滿意的,因為該效應僅是短暫的,特別是在快速分裂的細胞中。這可以通過產生siRNA的表達載體來克服。修飾siRNA序列以在兩條鏈之間引入短環。得到的轉錄物是短髮夾RNA(shRNA),其可以通過Dicer以其通常的方式加工成功能性siRNA。典型的轉錄盒使用RNA聚合酶III啟動子(例如,U6或H1)來指導小核RNA(snRNA)的轉錄(U6參與基因剪接; H1是RNase)人RNase P)的成分。理論上,所得的siRNA轉錄物然後由Dicer處理。
通過使用細胞擠壓也可以提高基因敲低效率。
RNAi中siRNA的活性很大程度上取決於其與RNA誘導的沉默複合物(RISC)的結合能力。雙鏈體siRNA與RISC的結合之後是用內切核酸酶解開和切割有義鏈。然後剩餘的反義鏈-RISC複合物可以與靶mRNA結合以啟動轉錄沉默。
已經發現dsRNA還可以激活基因表達,這種機制被稱為“小RNA誘導的基因激活”或RNAa。已經顯示靶向基因啟動子的dsRNA誘導相關基因的有效轉錄激活。使用合成的dsRNA在人細胞中證明RNAa,稱為“小活化RNA”(saRNA)。目前尚不清楚RNAa是否在其他生物體中是保守的。
siRNA誘導的轉錄后基因沉默始於RNA誘導的沉默複合物(RISC)的組裝。該複合物通過切割編碼靶基因的mRNA分子來沉默某些基因表達。為了開始該過程,兩條siRNA鏈中的一條(引導鏈)將被裝載到RISC中,而另一條鏈即過客鏈被降解。某些Dicer酶可能負責將引導鏈載入到RISC中。然後,siRNA掃描並指導RISC到mRNA分子上完全互補的序列。認為mRNA分子的切割由RISC的Argonaute蛋白的Piwi結構域催化。然後通過切割與siRNA殘基10和11配對的靶核苷酸之間的磷酸二酯鍵精確切割mRNA分子,從5'端開始計數。這種切割導致mRNA片段被細胞核酸外切酶進一步降解。5'片段通過外來體從其3'末端降解,而3'片段從其5'末端通過5'-3'外切核糖核酸酶1(XRN1)降解。切割后靶mRNA鏈與RISC的解離允許更多的mRNA被沉默。這種解離過程很可能是由ATP水解驅動的外在因素促進的。
有時不會發生靶mRNA分子的切割。在一些情況下,磷酸二酯骨架的核酸內切裂解可以通過切割位點附近的siRNA和靶mRNA的錯配來抑制。其他時候,即使靶mRNA和siRNA完全配對,RISC的Argonaute蛋白也缺乏內切核酸酶活性。在這種情況下,基因表達將被miRNA誘導機制沉默。
Ping-Pong方法的簡化版本,涉及蛋白質Aubergine(Aub)和Argonaute-3(Ago3)切割piRNA的3'和5'末端。
Piwi相互作用的RNA負責轉座子的沉默,而不是siRNAs。
近年來,RNAi技術在病毒感染性疾病治療方面的應用已受到極大關注,尤其在AIDS、乙型肝炎和丙型肝炎等治療中的應用研究最為活躍。目前,在siRNA抗AIDS的研究中,針對HIV結構蛋白基因及長末端重複序列(longterminal repeat,LTR)的SiRNA可以控制病毒複製;針對宿主細胞HIV受體CD4基因的siRNA可有效控制病毒進入宿主細胞,抑制病毒的感染過程。但CD4是人體正常免疫功能不可缺少的分子,它的表達抑制勢必影響正常的免疫功能,由此設想針對CCR5、CCR4等共同受體設計siRNA,並正在試驗中。另外在抗病毒治療中,分別以丙型肝炎病毒、呼吸道合胞病毒、流感病毒、脊髓灰質炎病毒等基因組的編碼區或非編碼區為靶點設計的siRNA均取得了令人欣喜的體外抑制作用,但利用動物實驗模型驗證siRNA體內清除病毒的效果需進一步研究。
雖然RNAi有望成為抗病毒治療的有效工具,但病毒株靶基因的高度突變或鹼基丟失,如HIV和流感病毒,成為設計siRNA時必須考慮的問題。另外一種稱為病毒抑制子蛋白的發現使研究人員對RNAi的抗病毒效應有了更深的認識,研究發現這種病毒抑制子由病毒基因組編碼產生,最初在植物中發現,目前有報道別的真核生物中也存在,其與RNA干擾裝置競爭性的結合,通過阻斷siRNA的加工或干擾信號的傳遞等途徑抑制RNA干擾,從而降低其抗病毒的效應。
針對上述影響因素,在RNAi抗病毒的治療應用中,(1)靶序列的選擇最好是針對病毒的保守序列,以減少病毒變異的影響。(2)設計針對不同靶序列的多種SiRNA並聯合作用,以減少病毒逃逸的產生。(3)針對病毒進入細胞或病毒複製相關的宿主基因設計siRNA,如HIV受體CD4、CCR5等,這樣即使病毒高度變異,其逃逸RNA干擾的幾率也會大大降低。(4)針對病毒抑制子設計siRNA,可在一定程度上減少或避免病毒抑制子的產生,並且隨著對RNA干擾的深入研究,將會有越來越多的相關報道。綜上所述,RNAi在抗病毒治療應用方面雖取得很大的突破,但其應用於臨床還有待更深的研究。