線性自由能關係
線性自由能關係
著名的哈米特方程、塔夫脫方程、布侖斯惕酸鹼催化定律和斯溫方程都屬於這種關係。
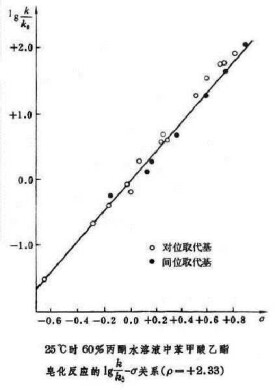
1937年美國的L.P.哈米特研究了許多系列芳族化合物的反應速率常數和平衡常數與取代基之間的定量關係。在這些系列化合物中,每個化合物都有一個相同的反應中心,但在該反應中心的間位和對位上,有不同的取代基。哈米特發現,這些化合物中任一個化合物的反應速率常數或平衡常數可用方程
(1)
(1’)
近似算得(如圖1):式中分別是母體化合物的速率常數和平衡常數;k、K分別是取代的母體衍生物的速率常數和平衡常數;σ為取代常數。表示取代基的吸電子能力或電子能力大小。ρ為反應常數,是反應系列對取代基的靈敏度的度量。K、k與、的關係可用方程(2)、(3)(如圖2和圖3)表示:
(2)
(3)
式中為反應自由能的變化;為活化自由能的變化;R為氣體常數;k′為玻耳茲曼常數;h為普朗克常數;T為絕對溫度。
方程(1)、(1′)可分別寫成方程(4)、(4’)(如圖4和4.1):
(4)
(4’)
式中 為母體化合物的反應自由能變化;為母體化合物的活化自由能變化。
塔夫脫方程50年代R.W.塔夫脫髮現:當反應中心不是共軛體系的一個部分,取 代基與反應中心之間的立體效應的程度在反應過程中沒有明顯變化時,則脂肪族化合物的活性與結構之間的定量關係可以用與哈米特方程相似的方程(如圖5)來描述:
式中σ*為極性取代基常數,表示取代基沿脂肪族鏈傳遞的吸電子能力。它的值可由方程(如圖6)計算:
k為取代的乙酸乙酯的水解速率常數;為乙酸乙酯的水解速率常數;為鹼催化 (見酸鹼催化作用)的速率常數之比;為酸催化的速率常數之比;ρ*為反應常數。同樣,方程(5)可寫成方程(如圖7):布侖斯惕酸鹼催化定律 40年代R.P.貝爾等研究了乙醛水合物的脫水反應后發現,這個反應可由32種羧酸催化,其催化速率常數的對數與酸的酸度常數的對數之間的關係非常接近於線性關係,可用方程(如圖8)近似地表示:式(8)和同它類似的一般鹼催化表達式為
構成布侖斯惕酸鹼催化定律。上式中,是一般酸鹼催化速率常數,分別是酸度常數和鹼度常數,a、b分別是直線的斜率和截距。利用方程(2)、(3)、(8)、(9)及有關公式可寫成方程:式中N為阿伏伽德羅數。
斯溫方程C.G.斯溫定量地描述了親核取代反應速率常數與作用物、進攻試劑和溶劑之間的關係(如圖11):式中n為親核試劑的親核性參數;e為親電試劑的親電性參數;為反應對親核電子推的靈敏程度;為反應對親電電子拉的靈敏程度。利用相似的原理,方程(如圖11)可寫成方程(如圖12) :由於方程(4)、(7)、(10)、(12)都是自由能的直線方程,把它們統稱為線性自由能關係。
有機化學中 BEP原理是反應活化能(ΔE)與反應熱(ΔH)之間的一種近似的線性關係(如圖13),實質上也可歸屬於線性自由能關係:式中A、B為常數。線性自由能關係的發現,標誌著有機化學中結構與性能之間的關係的研究開始由定性進入到定量的階段。