免疫耐受
免疫耐受
這不同於免疫缺陷或使用免疫抑製劑后造成的抑制狀態,不會導致自身免疫病的發生稱為免疫耐受。引起免疫耐受的抗原稱為耐受原。如自身組織抗原,引起天然免疫耐受;非自身抗原(如病原微生物和異種組織抗原等),在一定條件下可以是免疫原,也可以是耐受原。
早在20世紀中葉,科學家們就發現,在胚胎時期或新生兒,引入外源抗原,很容易誘導個體發生對該抗原的耐受,在正常情況下,胎兒與外部抗原刺激是隔離開的,它的淋巴系統只會遇到自身抗原,從而導致了自身免疫反應的消除。免疫系統在發育過程中學會了耐受,它的任務是通過T 細胞和B 細胞抗原受體基因的重排下產生隨機的結構多樣性,識別不期而遇的分子並作出反應,因而是一種獲得性現象,需要抗原誘導才能產生,即便是對自身抗原的耐受也是如此。這就使 Burnet學說於1960年獲諾貝爾獎,並對70年代免疫學的快速發展起到了巨大的推動作用。
因而有下列情況之一者,耐受將形成:
1.外來抗原具有與機體表面抗原相同的表位。
2.在胚胎時期未建立與淋巴細胞接觸,即人體免疫隔離部位(如眼晶狀體蛋白等在正常情況下被屏障隔離於免疫系統之外,若因外傷溢出接觸淋巴細胞,可誘導強免疫應答,導致交感性眼炎)。
3.機體免疫系統有缺陷,使得具調節作用的淋巴細胞生成有障礙。
(天然性免疫耐受)目前認為固有性免疫系統免疫耐受有兩種機制:
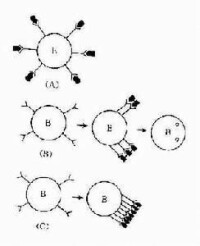
免疫耐受的機制
(獲得性免疫耐受)包括中樞耐受和外周耐受。
1.中樞耐受:是指在中樞免疫器官(胸腺和骨髓)內, T 和B 淋巴細胞在發育中,尚未成熟前,能識別自身抗原的細胞克隆被清除或處於無反應性狀態而形成的自身耐受。如T 細胞在胸腺內發育過程中,經過陽性選擇和陰性選擇,識別自身抗原的未成熟T 細胞凋亡。B 細胞在骨髓內發育到表達mIgM 的未成熟B 細胞,經過陰性選擇自身反應性細胞克隆消除或處於無反應性狀態。
2.外周耐受:是指在外周免疫器官,成熟的T 和B 淋巴細胞遇到自身或外源性抗原形成的耐受。其發生機制有:
①克隆無反應性(clonal anergy,又稱克隆麻痹),是指在某些情況下,T、B 細胞雖然仍有與抗原反應的TCR 或mIg 表達,但對該抗原呈功能上無應答或低應答狀態。如成熟T 細胞活化需要兩種(或兩種以上)信號之一缺乏,T 細胞不能被活化,處於無反應狀態;成熟B 細胞缺少刺激信號(如缺乏Th 細胞輔助作用),不能活化,處於無反應狀態。
②克隆忽視(clonal ignorance),指免疫細胞接觸不到“隱蔽抗原”,使抗原處於被忽視狀態。
③活化誘導的細胞死亡(AICD),通過T 細胞-B 細胞或T 細胞-T 細胞之間的FasL(CD178)和Fas(CD95)的結合,啟動AICD,使自身反應性T 細胞或B 細胞被消除。
④免疫調節細胞(如調節性T 細胞)分泌抑制性細胞因子致免疫耐受。
⑤獨特型網路可致免疫耐受。
(一)人工誘導免疫耐受的意義:用於自身免疫病、超敏反應性疾病、器官移植排斥等的治療。
(二)人工誘導免疫耐受形成的條件:取決於抗原和機體二個方面。
免疫耐受的機制
3.抗原注射的途徑,抗原經鼻內、口服、靜脈注射最易誘導耐受,腹腔注射次之,皮下及肌肉注射不易誘導機體產生耐受。口服耐受是指體外給予抗原,通過腸道刺激外周免疫系統產生免疫耐受。
4.抗原在體內的持續時間,抗原持續存在刺激免疫耐受,抗原消失免疫耐受逐漸消退。
5.抗原不加佐劑易致耐受。
1.免疫系統的成熟度,胚胎期或新生期易誘導免疫耐受,成年期不易誘導免疫耐受。
2.採用免疫抑制措施,如X 線全身照射、胸導管引流、應用抗淋巴細胞單克隆抗體和免疫抑製劑等破壞、去除或抑制淋巴細胞。
3.使用第二信號阻斷劑,如:抗CD40 配體、胸腺內移植異種抗原等。
1.對自身成分的免疫無應答性不決定於遺傳,而是後天形成的。
2.自身耐受性形成的原因是自身抗原。
3.淋巴系細胞的抗原反應性無論自身抗原及非自身抗原均無定向表達,若將其中對自身的反應性細胞除去,結果可形成僅對非自身的免疫機制。不僅對自身成分,而且對外來抗原的免疫耐受性也可在後天形成。
①動物的年齡:在胚胎期建立免疫耐受性最易,新生期次之,成年期比較困難。這可能與機體在各時期的免疫系統成熟程度有關;
②免疫反應性的強弱:免疫反應性強的個體不易產生免疫耐受性,有免疫缺陷的動物,不管是自發的還是使用免疫抑製劑,都很容易誘發免疫耐受性;
③動物的種屬:腸鼠和綿羊難以誘發免疫耐受性,兔和猴只有在胚胎期才能誘發免疫耐受性,小鼠、大鼠和地鼠比較容易誘發;
④免疫抑製劑的影響:這是一種外源性非特異性抑制免疫功能的因素。用大劑量X射線照射和用各種免疫抑製劑,可抑制全部免疫應答,而在給予適當劑量藥物的同時給予抗原,可誘發對該抗原的免疫耐受性。
①抑制的性質:能誘發免疫耐受性的抗原物質稱為耐受原。主要耐受原有蛋白質、細菌或病毒抗原、半抗原和合成多肽。不易從體內清除的抗原比易被清除的抗原容易誘發免疫耐受性。在體內不易被代謝的耐受原可比易被代謝的耐受原維持免疫耐受性的時間長;
②抑制的途徑和方式;最易誘發免疫耐受性是靜脈注射,其次是腹腔注射,再次是皮下注射。口服一般不能誘發免疫耐受性。如在注射抗原時使用免疫佐劑,也不易引起免疫耐受性;
③抗原抑製劑量:影響誘發免疫耐受性的因素很多,難以定出固定的誘發量。一般認為中等劑量容易誘發免疫應答,而不易誘發免疫耐受性。非胸腺依賴性抗原大劑量時比較容易誘發免疫耐受性;胸腺依賴性抗原用小劑量或大劑量均可誘發免疫耐受性。用大劑量抗原誘發的免疫耐受性稱為高量免疫耐受性,用低劑量誘發的免疫耐受性稱為低量免疫耐受性;
④抑制決定簇的密度:決定簇的密度愈大,愈容易誘發免疫耐受性
人工終止耐受是指使用擬抗原物質,特異性地破壞或終止已建立的免疫耐受性。通過終止耐受,可治療腫瘤和慢性感染等疾病。終止耐受的方式有通過理化或生物因素改變耐受原結構,投給與耐受原結構類似的交叉抗原,提高第二刺激信號分子B7、CD40 等的表達等。
已建立了耐受性的個體如無抗原的再度刺激,免疫耐受性隨著體內抗原被清除而自行消退,重新出現對特異抗原的免疫應答,此即為免疫耐受性的自發終止。
使用各種模擬抗原物質,可特異地破壞已建立的耐受性。
1.注射化學結構改變的耐受原如通過理化及生物因素使抗原結構改變。
2.注射置換載體的新抗原將耐受原的半抗原部分連接到另一載體上,形成新抗原。例如,事先以BSA-DNP誘發家兔產生耐受性,將DNP連接至HAS上,若將其注射至耐受家兔,可使其再度出現抗DNP抗體,即原有的特性免疫耐受性終止。
3.注射與耐受原有交叉反應的抗原具有共同抗原決定簇的各種抗原物質能夠誘導交叉反應。人體對自身抗原有免疫耐受性,接受交叉抗原刺激后,可能導致自身耐受性的終止,而出現自身免疫性。
醫學上對免疫耐受的研究,有助於對免疫疾病的治療和預防。器官移植可使許多病人獲救,但由於HLA不匹配,移植物難於長期存活,如能使受體建立有效的耐受,則器官移植術必將有驚人突破。
腫瘤是危害人類健康的主要疾病之一,機體免疫監視功能發生障礙時,對腫瘤抗原產生免疫耐受。如能破壞腫瘤抗原的耐受,恢復抗腫瘤活性,將能制止腫瘤的發生。
一些慢性傳染病,長期難以治癒,就是發生了免疫耐受。如乙型病毒性肝炎等。如何中止免疫耐受,恢復機體免疫應答,對許多慢性傳染病患者將是一個極大福音。
隨著分子免疫學的研究和發展,免疫耐受在醫學上將有關鍵性突破。
抗原性物質進入機體后,有時導致正相免疫應答,有時導致免疫耐受或負相免疫應答。這兩種不同免疫應答的出現,取決於諸多因素的影響,而主要與抗原物質及機體兩方面的因素有關。
(一)抗原的性質
耐受原僅是一個功能性定義,有許多因素可影響某抗原使之成為免疫原或耐受原。例如牛或人的丙種球蛋白(BGG、HGG)呈大分子聚合狀態時具免疫原性,而分子較小的非聚合單體則是良好的耐受原。給動物注射這種耐受原后,對以後再注入的聚合丙種球蛋白表現為無應答。一般來說分子量小的抗原其免疫原性差,導致耐受能力強,並隨分子量大小而遞減或遞增。例如多聚鞭毛素(分子量104KD)、單體鞭毛素(分子量40KD)及由單體鞭毛素提取的成分A(分子量18kD)三者的免疫原性依次遞減,而致耐受原性則依次遞增。
此外,可溶性抗原常為致耐原,而顆粒性抗原則易於引起正相免疫應答。易被吞噬細胞迅速攝取的抗原常誘發免疫應答,而緩慢或不易被吞噬細胞攝取的抗原則多為致耐原。抗原表位密度高,即抗原分子表面具有許多相同重複的抗原決定簇者,其致耐原強。
(二)抗原的劑量
足以誘導耐受的抗原劑量隨抗原種類、動物的種屬、品系及年齡、且參與效應細胞類型等的不同而有所差異。一般來說,抗原劑量越大所誘導的耐受越完全和持久。
Mitchison在1964年首先報告高、低帶耐受性(high-zone,low-xone tolerance)現象。當他給小鼠注射低劑量(10-8M)與高劑量(10-5M)牛血清白蛋白(BSA)后,動物出現耐受。而中等劑量(10-7M)BSA引起良好的免疫應答。
T、B細胞產生耐受所需抗原劑量明顯不同。T細胞所需抗原量較B細胞要小100-10000倍,而且發生快(24小時內達高峰),持續長(數月)。而B細胞形成耐受不但需要抗原量大,且發生緩慢(1-2周),持續時間短(數周)。
Waigle研究指出,小劑量抗原引起T細胞耐受,而大劑量抗原則引起T細胞和B細胞都耐受。
致耐受所需抗原量與個體的年齡有關,即隨年齡相應增大。與抗原的類別亦有關,即強免疫原性抗原大量注入時能引起耐受,繼續注入大量抗原使耐受性增強;胸腺非依賴抗原高劑量易致耐受,胸腺依賴抗原用高、低劑量均可引起耐受。
(三)抗原注射途徑
一般來說,抗原經靜脈注射最易誘導耐受性,腹腔注射次之,皮下及肌肉注射最難。但不同的部位靜脈注射引起後果可各異。HGG經頸靜脈注入引起免疫,腸系膜靜脈注入引起耐受;IgG或白蛋白注入靜脈能致耐受,注入周圍靜脈則引起免疫應答。有些半抗原經皮內注射能誘導抗體生成及遲髮型變態反應,但通過口服則發生耐受性。
通過腸系膜及門靜脈注射易於致耐受的原因可能是由於肝起著生物學過濾的作用,將抗原解聚,聚合抗原被肝內枯否細胞吞噬降解,從而除去了免疫原性強的抗原部分,剩下非聚合抗原進入外周血流或淋巴道。
(一)年齡因素
年齡與耐受易感程度密切相關。Owen與Billingham等人的資料表明胚胎期與新生期的免疫系統接觸抗原(不論是天然或人工的)后,極易導致終生或長期的耐受性。其後,許多實驗證實這一現象的普遍性。這主要與免疫系統發育未成熟有關,體外實驗證明未成熟細胞大30倍以上。成年機體一般亦不易誘導耐受,常須聯合應用其他免疫抑制措施,以加速其誘導過程。
(二)遺傳因素
小鼠免疫耐受及維持的難易程度隨品系不同而異。自身免疫病好發鼠(NZB×NAW)F1品系難於誘導耐受,所誘導出的耐受性維持時間短。所有自發產生類似人類系統性紅斑狼瘡(SLE)品系小鼠不易用半抗原或非聚合的免疫球蛋白誘發耐受。
(三)免疫抑制的聯合應用
前已提及,單獨使用抗原一般不易對成年機體誘發耐受性,而常需要與各種免疫抑制措施聯合應用。常用的有效方法是全身淋巴組織照射,應用抗淋巴細胞血清(anti-lym-phocyte serum,ALS),抗TH細胞抗體(人抗CD4、小鼠抗L3T4),環磷醯胺,環孢素A,糖類皮質激素等免疫抑製藥物。
上述現象不僅已被許多實驗所證明,而且在器官移植臨床工作中已被證實是延長移植物存活的有效措施,認為是常規防止移植物排斥的方法。
例如環磷醯對抗原誘導免疫耐受有促進作用。現已證明,環磷醯胺同時作用於T及B細胞。它參與免疫耐受誘導的機制可能與其阻止B細胞表面免疫蛋白受體的再生有關。
又如全身淋巴組織照射時用鉛板遮蔽骨髓、肺及其他生命重要的非淋巴器官,因此劑量即使高達40戈瑞(Cy)亦無副反應。這種處理可使機體胸腺及二級淋巴器官中已成熟的淋巴細胞受到破壞,造成類似新生期的狀態。此時胸腺和二級淋巴器官中未成熟的淋巴細胞可重新形成集落,細胞表面雖有抗原受體表達但尚未發育成熟。因此,全身淋巴組織照射后能用多種抗原誘導出持久的免疫耐受,如輸注同種異體骨髓能建立起同種骨髓嵌合體且不發生移植物抗宿主病。這種情況下,耐受性的維持與體內產生特異性的抑制細胞有關,稱為天然抑制細胞。這種細胞見於新生及照射過的動物脾內,它們不具有通常T細胞表面標誌,表型類似NK細胞,但對NK細胞敏感的靶細胞並無殺傷作用。
首先,免疫耐受的誘導、維持和破壞影響著許多臨床疾病的發生、發展和轉歸。人們企圖誘導和維持免疫耐受性來防治超敏性疾病、自身免疫性疾病以及移植物的排斥反應。某些感染性疾病以及腫瘤生長過程中,設法解除免疫耐受、激發免疫應答將有利於對病原體的清除及腫瘤的控制。
根據免疫耐受發生機制的多樣性,對Ⅰ型變態反應患者誘導免疫耐受的可能途徑是通過B克隆清除或主動抑制。處理的方法有注射表面高密度多聚耐受原、變性蛋白抗原或脫敏療法等。
自身免疫病的發生至今認為主要與自身耐受的破壞有關,去除導致耐受破壞的因素,當然有利於對自身免疫病的防治。
現代醫學雖然已將古人幻想的器官移植變為現實,但同種異體免疫排斥現象仍是器官移植中主要存在的問題。免疫抑制療法上的進步有利於延長移植物存活,但非特異抑制所帶來的副作用仍有待解決。若能將特異抑制(免疫耐受)成功地應用於臨應,收到較好的效果,無疑是在此領域中的重大突破。
在麻風及慢性粘膜皮膚念珠菌病患者中,若體內出現良好的細胞免疫應答,雖抗體生成低下或甚至缺如,臨床預后仍良好,並常伴隨有效的防禦性免疫。反之,如細胞免疫水平低下,抗體效價雖高,而預后較差,多呈進行性感染。這種分離耐受現象對感染性疾病的預後有重要影響。乙型肝炎病毒攜帶者伴有極輕微的肝炎病變,可能與新生期發生感染而使機體對病毒產生部分耐受性有關。
在對腫瘤患者的免疫治療中,解除患者的免疫耐受狀態也是一項有意義的措施。美國兩家實驗室報導將一種協同刺激因子B7的基因轉染黑色素瘤細胞,並用這種轉染細胞進行防治黑色素瘤的實驗性研究,獲得可喜的成功。為這一領域的研究開闊了新的途徑。
