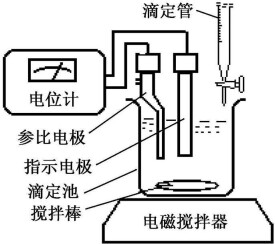
電位滴定法
不需要準確測量電位值的方法
電位滴定法,專業術語,拼音為diàn wèi dī dìng fǎ,是在滴定過程中通過測量電位變化以確定滴定終點的方法,和直接電位法相比,電位滴定法不需要準確的測量電極電位值,因此,溫度、液體接界電位的影響並不重要,其準確度優於直接電位法,普通滴定法是依靠指示劑顏色變化來指示滴定終點,如果待測溶液有顏色或渾濁時,終點的指示就比較困難,或者根本找不到合適的指示劑。電位滴定法是靠電極電位的突躍來指示滴定終點。在滴定到達終點前後,滴液中的待測離子濃度往往連續變化n個數量級,引起電位的突躍,被測成分的含量仍然通過消耗滴定劑的量來計算。
使用不同的指示電極,電位滴定法可以進行酸鹼滴定,氧化還原滴定,配合滴定和沉澱滴定。酸鹼滴定時使用PH玻璃電極為指示電極,在氧化還原滴定中,可以從鉑電極作指示電極。在配合滴定中,若用EDTA作滴定劑,可以用汞電極作指示電極,在沉澱滴定中,若用硝酸銀滴定鹵素離子,可以用銀電極作指示電極。在滴定過程中,隨著滴定劑的不斷加入,電極電位E不斷發生變化,電極電位發生突躍時,說明滴定到達終點。用微分曲線比普通滴定曲線更容易確定滴定終點。
如果使用自動電位滴定儀,在滴定過程中可以自動繪出滴定曲線,自動找出滴定終點,自動給出體積,滴定快捷方便。
進行電位滴定時,被測溶液中插入一個參比電極,一個指示電極組成工作電池。隨著滴定劑的加入,由於發生化學反應,被測離子濃度不斷變化,指示電極的電位也相應地變化。在等當點附近發生電位的突躍。因此測量工作電池電動勢的變化,可確定滴定終點。
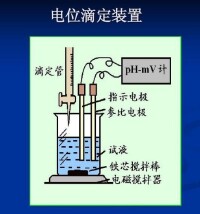
滴定管
用繪製電位確定曲線的方法。
電位滴定曲線即是隨著滴定的進行,電極電位值(電池電動勢)E對標準溶液的加入體積V作圖的圖形。
根據作圖的方法不同,電位滴定曲線有三種類型,E-V曲線,普通電位滴定曲線,拐點e即為等當點。
拐點的確定:作兩條與滴定曲線相切的45°傾斜的直線,等分線與曲線的交點即是拐點。
Ee為等當點電位。
Ve為等當點所需加的標準溶液的體積。
電位突躍範圍和斜率越大,分析誤差就越小。
曲線,一次微商曲線,一階導數曲線。
曲線峰頂e點即為等當點,(作圖時需先求出)
用相鄰兩次的E,V值求。
為0時為等當點。
式中的V1、V2為值的計算值。
電位滴定法比起用指示劑的容量分析法有許多優越的地方,首先可用於有色或混濁的溶液的滴定,使用指示劑是不行的;在沒有或缺乏指示劑的情況下,用此法解決;還可用於濃度較稀的試液或滴定反應進行不夠完全的情況;靈敏度和準確度高,並可實現自動化和連續測定。因此用途十分廣泛。
按照滴定反應的類型,電位滴定可用於中和滴定(酸鹼滴定)沉澱滴定,絡合滴定,氧化還原滴定。
電位滴定曲線的一次微分曲線
指示電極:玻璃電極,銻電極;
參比電極:甘汞電極;
(2)在乙醇介質中用HCl溶液滴定三乙醇胺
(3)在異丙醇和乙二醇混合溶液中HCl溶液滴定苯胺和生物鹼;
(4)在二甲基甲醯胺介質中可滴定苯酚;
參比電極:雙鹽橋甘汞電極;甘汞電極
(1)指示電極:銀電極
標準溶液:AgNO₃;
滴定對象:Clˉ、Brˉ、Iˉ、CNSˉ、Sˉ²、CNˉ等。
可連續滴定Clˉ、Brˉ、Iˉ;
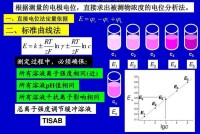
圖解法
標準溶液:硝酸汞;
滴定對象:Clˉ、Brˉ、Iˉ、CNSˉ、Sˉ²、C₂O₄ˉ²等。
(2)指示電極:鉑電極
標準溶液:K₄[Fe(CN)6;
滴定對象:Pd²﹢、Cd²﹢、Zn²﹢、Ba²﹢等。
參比電極:甘汞電極;
指示電極:鉑電極;
(1)標準溶液:高錳酸鉀;
滴定對象:Iˉ、NO₃ˉ、Fe²﹢、V⁴﹢、Sn²﹢、C₂O₄²ˉ。
(2)標準溶液:K₄[Fe(CN)6;
滴定對象:Co²﹢。
(3)標準溶液:K₂Cr₂O7;
滴定對象:Fe²﹢、Sn²﹢、Iˉ、Sb³﹢等。
參比電極:甘汞電極;
標準溶液:EDTA
(1)指示電極:汞電極;
滴定對象:Cu²+、Zn²+、Ca²+、Mg²+、Al³+。
(2)指示電極:氯電極;
用氟化物滴定Al³+。
(3)指示電極:鈣離子選擇性電極;
滴定對象:Ca²+等。