Fret
Fret
FRET 即熒光能量共振轉移(Fluorescence resonance energy transfer,)是較早發展起來的一門技術,而熒光能量共振轉移現象是20世紀初發現的,隨著綠色熒光蛋白應用技術的發展,FRET已經成為檢測活體中生物大分子納米級距離和納米級距離變化的有力工具,在生物大分子相互作用分析、細胞生理研究、免疫分析等方面有著廣泛的應用。
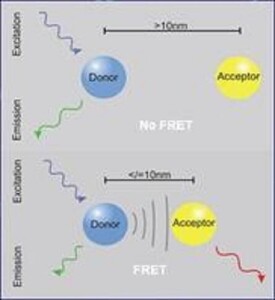
熒光能量共振轉移是距離很近的兩個熒光分子間產生的 一種能量轉移現象。當供體熒光分子的發射光譜與受體熒光分子的吸收光譜重疊,並且兩個分子的距離在10nm範圍以內時,就會發生一種非放射性的能量轉移,即FRET現象,使得供體的熒光強度比它單獨存在時要低的多(熒光猝滅),而受體發射的熒光卻大大增強(敏化熒光)。
在生命科學領域,FRET技術是檢測活體中生物大分子納米級距離和納米級距離變化的有力工具,可用於檢測某一細胞中兩個蛋白質分子是否存在直接的相互作用。正如前述,當供體發射的熒光與受體發色團分子的吸收光譜重疊,並且兩個探針的距離在10nm範圍以內時,就會產生FRET現象。而在生物體內,如果兩個蛋白質分子的距離在10nm之內,一般認為這兩個蛋白質分子存在直接相互作用。 FRET技術得以在生物體內廣泛應用,與綠色熒光蛋白(green fluorescent protein,GFP)的應用和改造是密不可分的。 GFP由11個β片層組成桶狀構成疏水中心,由α螺旋包含著的發光基團位於其中。這個發光基團(chromophore)是由3個氨基酸(Ser65、Tyr66、Gly67)經過環化、氧化后形成的咪唑環,在鈣離子激發下產生綠色熒光。野生型GFP吸收紫外光和藍光,發射綠光。通過更換GFP生色團氨基酸、插入內含子、改變鹼基組成等基因工程操作,實現對GFP的改造,如增強其熒光強度和熱穩定性、促進生色團的摺疊、改善熒光特性等。 GFP近年來發展出了多種突變體,通過引入各種點突變使發光基團的激發光譜和發射光譜均發生變化而發出不同顏色的熒光,有BFP,YFP,CFP等。這些突變體使GFP應用於FRET成為可能,為FRET技術用於活體檢測蛋白質相互作用提供了良好的支持。
青色熒光蛋白(cyan fluorescent protein, CFP)、黃色熒光蛋白(yellow fluorescent protein, YFP)為目前蛋白-蛋白相互作用研究中最廣泛應用的FRET對。CFP的發射光譜與YFP的吸收光譜相重疊。將供體蛋白CFG和受體蛋白YFG分別與兩種目的蛋白融合表達。當兩個融合蛋白之間的距離在5-10nm的範圍內,則供體CFP發出的熒光可被YFP吸收,並激發YFP發出黃色熒光,此時通過測量CFP熒光強度的損失量來確定這兩個蛋白是否相互作用。兩個蛋白距離越近,CFP所發出的熒光被YFP接收的量就越多,檢測器所接收到的熒光就越少。如Tsien & Miyawaki採用FRET技術檢測細胞內Ca 的濃度變化。他們將CFP和YFP分別於鈣調蛋白和鈣調蛋白結合肽融合表達於同一個細胞內。當細胞內具有高的Ca 濃度時,鈣調蛋白和鈣調蛋白結合肽結合,可誘發FRET,使受體蛋白YFP發出黃色熒光,因此細胞呈黃色。當細胞內Ca 濃度低時,FRET幾乎不發生,因此檢測時CFP被激發,發出綠色熒光,細胞呈綠色。