綠色熒光蛋白
綠色熒光蛋白
綠色螢光蛋白(Green fluorescent protein;簡稱GFP),由下村脩等人於1962年在維多利亞多管發光水母中發現,其基因所產生的蛋白質,在藍色波長範圍的光線激發下,會發出綠色螢光,整個發光的過程中還需要冷光蛋白質水母素的幫助,冷光蛋白質與鈣離子(Ca2+)可產生交互作用。2008年10月8日,日本科學家下村脩、美國科學家馬丁·查爾菲和錢永健因為發現和改造綠色熒光蛋白獲得了諾貝爾化學獎。綠色螢光蛋白現常被用來研究骨架和細胞分裂、動力學和泡囊運輸、發育生物學等,並可應用於轉染細胞的確定、體內基因表達的測定、蛋白質分子的定位、細胞間分子交流的動態監測等。
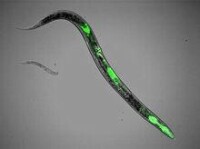
科學家在線形蟲體內植入綠色熒光蛋白質
,395nm和475nm分別是最大和次大的激發波長,它的發射波長的峰點是在509nm,在可見光綠光的範圍下是較弱的位置。由海腎(sea pansy)所得的綠色熒光蛋白,僅有在498nm有一個較高的激發峰點。
在細胞生物學與分子生物學領域中,綠色熒光蛋白基因常被用作為一個報導基因(reporter gene)。一些經修飾過的型式可作為生物探針,綠色熒光蛋白基因也可以克隆到脊椎動物(例如:兔子上進行表現,並拿來映證某種假設的實驗方法。
在生物學研究中,科學家們常常利用這種能自己發光的熒光分子來作為生物體的標記。將這種熒光分子通過化學方法掛在其他不可見的分子上,原來不可見的部分就變得可見了。生物學家一直利用這種標記方法,把原本透明的細胞或細胞器從黑暗的顯微鏡視場中“揪出來”。
傳統的熒光分子在發光的同時,會產生具有毒性的氧自由基,導致被觀察的細胞死亡,這叫做“光毒性”,因此,在綠色熒光蛋白髮現以前,科學家們只能通過熒游標記來研究死亡細胞靜態結構,而綠色熒光蛋白的光毒性非常弱,非常適合用於標記活細胞。
然而,綠色熒光蛋白被發現20多年後,才有人將其應用在生物樣品標記上。1993年,馬丁·沙爾菲成功地通過基因重組的方法使得除水母以外的其他生物(如大腸桿菌等)也能產生綠色熒光蛋白,這不僅證實了綠色熒光蛋白與活體生物的相容性,還建立了利用綠色熒光蛋白研究基因表達的基該方法,而許多現代重大疾病都與基因表達的異常有關。至此,生物醫學研究的一場“綠色革命”揭開了序幕。
後來,美籍華人錢永健系統地研究了綠色熒光蛋白的工作原理,並對它進行了大刀闊斧的化學改造,不但大大增強了它的發光效率,還發展出了紅色、藍色、黃色熒光蛋白,使得熒光蛋白真正成為了一個琳琅滿目的工具箱,供生物學家們選用。目前生物實驗室普遍使用的熒光蛋白,大部分是錢永健改造的變種。
有了這些熒光蛋白,科學家們就好像在細胞內裝上了“攝像頭”,得以實時監測各種病毒“為非作歹”的過程。通過沙爾菲的基因克隆思路,科學家們還培育出了熒光老鼠和熒光豬,由於沙爾菲與錢永健的突出貢獻,他們與綠色熒光蛋白的發現者下村修共享了2008年的諾貝爾化學獎。
瑞典皇家科學院將綠色熒光蛋白的發現和改造與顯微鏡的發明相提並論,成為當代生物科學研究中最重要的工具之一。
骨架和細胞分裂
Kevin Sullivan's 實驗室
酵母菌內SPB 和微管動力學
酵母菌中肌動蛋白的動力
果蠅中MEI-S332蛋白
果蠅有絲分裂和mRNA運輸
網丙菌屬細胞骨架
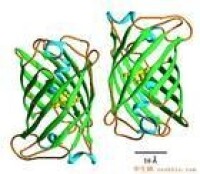
綠色熒光蛋白應用
網丙菌屬的趨化作用
網丙菌屬中細胞骨架動力和細胞運動
核動力
網丙菌屬中細胞動力
細胞骨架動力和胞內運輸
動力學和泡囊運輸
用GFP顯示小囊運輸
用GFP觀察TGN運輸
細胞骨架動力學和胞內運輸
發育生物學
用GFP觀察線蟲的神經發育
分析果蠅神經發育的不對稱性細胞分裂
線蟲Lin-14
Fischbach lab
用GFP觀察網丙菌屬的形態發生學
GFP在小鼠發育中的標記方法
生物技術中的應用研究
1.分子標記
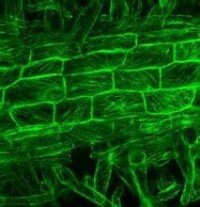
GFP標記的微管
組技術,將目的基因與GFP基因構成融合基因,轉染合適的細胞進行表達,然後藉助熒光顯微鏡便可對標記的蛋白質進行細胞內活體觀察。由於GFP相對較小,只有238個氨基酸,將其與其他蛋白融合后不影響自身的發光功能,利用GFP的這一特性已經加深了我們對細胞內一些過程的了解,如細胞分裂、染色體複製和分裂,發育和信號轉導等。1996年,Ehrdardt等人首次報道了利用GFP的特性研究細胞分化蛋白FtsZ的定位。研究顯示FtsZ在細胞分裂位點形成了一個環狀物,且至少有9種蛋白在細胞分裂中起重要作用,儘管對這些蛋白功能仍然不是很清楚,但是利用GFP融合蛋白已經搞清楚了它們聚合的順序以及在蛋白定位中的一些特徵。利用GFP來檢測目標蛋白的定位已為我們提供了一種對細胞內的一些基本的生理過程進行更詳盡觀察的新方法。
除用於特定蛋白的標記定位外,GFP亦大量用於各種細胞器的標記如細胞骨架、質膜、細胞核等等。Shi等人曾報道將GFP融合到大腸桿菌細胞膜表面用作標記蛋白,這一技術將有助於提高多肽庫的篩選效率、疫苗的研製、構建細胞生物感測器用作環境檢測以及探測信號轉導過程等等。這些都為傳統生物學研究提供了新思路和新方法,成為交叉學科研究的熱點。
c為藥物篩選的GFP
探針分佈是利用信號傳導中信號分子的遷移功能,將一熒光蛋白與信號分子相偶聯,根據熒光蛋白的分佈情況即可推斷信號分子的遷移狀況,並推斷該分子在遷移中的功能。由於GFP分子量小,在活細胞內可溶且對細胞毒性較小,因而常用作熒光探針。
在細胞體內分子之間的相互作用非常複雜,其中很多涉及到信號分子在細胞器之間的遷移。例如當信號分子和某一特殊受體結合后常會導致配體-受體複合物從某一細胞區域遷移到另一區域,而這一遷移過程通常會介導一重要的生理功能。因而,這些受體常常被用作藥物篩選的目標,若某一藥物具有與信號分子類似的功能,那麼該藥物即具有潛在的醫藥價值。利用GFP熒光探針,將很容易從數量眾多的化合物中判斷出哪些化合物具有與信號分子相似的能引起配體一受體複合物遷移並介導生理反應的功能,且這一篩選過程簡單方便,所需成本也很低。利用這一原理,已經成功構建了一個篩選模型用於研究藥物介導的糖皮質激素受體(hGR)的遷移過程。在一96孔板中培養細胞,並以一編碼hGR GFP蛋白的質粒轉染該細胞。當細胞用待篩選的藥物處理后,hGR-GFP從細胞質遷移人細胞核的過程可實時或在某一時段內被證實,根據熒光分佈即可推斷哪一種藥物具有與hGR配體相類似的功能。利用GFP來進行藥物篩選由於受其必須與遷移的信號分子相偶聯,其篩選容量相對較低,但是由於GFP在細胞內的穿透性強及獨特的發光機制,因而在藥物篩選中具有相當大的應用潛力。
3.融合抗體
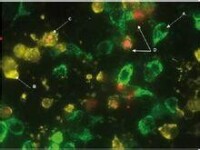
線粒體中表達的GFP
ariable fragment,ScFv)是研究得較多的一種小分子抗體,其優越性在於可在宿主細胞內大量表達,易於基因工程操作,尤其易於構建抗體融合蛋白。關於綠色熒光蛋白融合單鏈抗體的報道很多,國內也有相關報道,如程虹等報道將抗肝癌單鏈雙功能抗體融合GFP真核表達載體並導人小鼠成纖維細胞NIH3T3表達並獲得成功。因融合抗體具有與抗原結合及發射熒光兩種特性,故這一人工分子可用做免疫染色的檢測試劑,直接應用於流式細胞儀和免疫熒光的標記及腫瘤的檢測等等。
由於技術上的的原因,一般融合抗體均置於原核表達系統如E.coli中表達。為便於表達蛋白的分離純化,一般在單鏈抗體的N端或C端插入一6×His序列,便於用Ni-NTA親和層析柱純化目標蛋白。但這一技術也存在一些問題。由於抗體分子內存在二硫鍵,而在原核表達系統內由於抗體不能正確摺疊,容易形成包涵體,表達出來的目標蛋白無活性,需要在氧化還原體系中進行復性。但也有報道在動物細胞細胞質中成功表達出具有抗原結合活性的單鏈抗體。若能成功解決融合抗體的表達問題,則在免疫染色及腫瘤檢測這一領域融合抗體將扮演極為重要的角色。
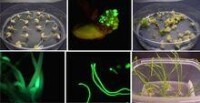
GFP在植物研究中的應用
子后引起的空間構象變化導致兩種GFP突變體間發生熒光共振能量轉移。但是由於大多數蛋白不能像鈣調蛋白那樣承受較大的空間構象變化,為克服這一缺點,人們開始提出利用基因融合技術將一新的分子識別位點結合到GFP上以構建新的分子感受器。Doi和Yanagawa根據這一原理將TEM1 β-內醯胺酶(Bla)融合到GFP上。當缺少目標分子時,GFP處於靜止狀態不會產生熒光。但是當目標分子β-內醯胺酶抑制蛋白(BLIP)與Bla結合后,即使GFP活化產生熒光,而這一變化很容易被檢測到。將受體蛋白插入到GFP表面的技術已經成為構建分子感受器的有力工具,這種GFP感受器能被用來檢測多種分子,如蛋白質、核酸、激素、藥物、金屬及其他的一些小分子化合物等,其潛在應用前景極為廣闊。
腫瘤發病機制的應用

將綠黃紅熒光蛋白質植入魚的DNA分子結構中
量分析目的基因的表達水平,顯示其在腫瘤細胞內的表達位置和量的變化,為探討該基因在腫瘤發生、發展中的作用及其分子機制提供便利條件。
在腫瘤的形成過程中,增殖和凋亡是一對相互矛盾的統一體。若腫瘤細胞凋亡佔優勢,腫瘤組織將長期處於休眠狀態或自行消亡。腫瘤細胞的凋亡受凋亡相關基因調控。用GFP轉染腫瘤細胞凋亡相關基因,並與正常組織進行比較,則大致可判斷此基因為抑制腫瘤細胞凋亡的基因;反之,為促進腫瘤細胞凋亡的基因。
腫瘤細胞浸潤是腫瘤細胞粘連、酶降解、移動和基質內增殖等一系列過程的表現,其根本原因在於腫瘤細胞內某些基因表達異常。利用GFP 的示蹤特性,研究腫瘤細胞內某些基因異常表達與腫瘤細胞浸潤的關係,即可揭示腫瘤細胞浸潤的某些機制。
在信號轉導中的應用
新近研究發現,某些突變的 GFP 能夠發生熒光共振能量轉移 (fluorescence resonance energy transfer,FRET)。FRET 是一種從熒光分子的激髮狀態到臨近基態接受分子之間量子力學能量轉移的現象。FRET 發生的前提條件是,熒光接受分子必須在熒光提供分子釋放態所具有的波長範圍內接受能量。如果供應分子和接受分子相互定位在幾個納米之內,則非常利於 FRET 的產生。因為 FRET 對於兩個熒光分子相互間的定位和距離高度敏感(在納米範圍內)。兩個分子間微小的線性或空間定位關係的破壞可以強烈地改變能量轉移的效率。由於 FRET 能量轉移並非是 100 % 的效率,一個實用而有效的檢測 FRET 的方法是,僅僅激發熒光供應分子,然後計算供應分子對於接受分子熒光釋放的比率。比值的變化是一個理想的觀測細胞動態變化的指標。因為它消除了 GFP 分子在絕對濃度、細胞的厚度、激發源的能量度以及檢測的絕對效率等的影響。利用 FRET 可以作成 GFP 依賴的生物探針,現已有研究人員設計大分子或分子配對物來改變 GFP 之間原有生理信號反應的 FRET。
研究發現可以通過調節 GFP 來改變 FRET。把一個釋放藍色熒光的 GFP 融合到一個綠色熒光 GFP 突變體上,並在它們之間介入一個蛋白酶敏感的間隔子,這兩個 GFP 恰好可以發生 FRET,當加入蛋白酶時,間隔子被切除,兩個 GFP 之間的距離發生彌散性改變,FRET 被完全阻斷。該實驗提示我們,可以通過偶聯 GFP 到適當的轉錄因子、跨膜受體、細胞間信號轉導指示分子,來動態觀測活細胞的生理功能。
在上述實驗基礎上,研究人員開始設計 FRET 依賴的 Ca 2+ 敏感指示劑,其設計原理是,鈣調蛋白 (CaM) 通過肌球蛋白輕鏈激酶(MLCK) 結合到 CaM 結合區。藍色熒光蛋白和綠色熒光蛋白通過 CaM 和 MLCK 區域融合在一起,當 Ca 2 + 增多時,形成更多的 Ca 2+ - CaM 複合物,並從 MLCK 結合到 CaM 結合區域。該實驗發現,通過改變兩個 GFP 之間的距離,可以增加 FRET。另有一些研究人員,並沒有把兩個 GFP 融合在一個單一結構中,而是把一個 GFP 融合到 CaM 上,另一個 GFP 融合到 CaM 結合區域。結果發現,當 Ca 2+ 結合到 CaM 上,出現分子間異源二聚體,兩個 GFP 足夠接近而產生 FRET。這個實驗提示了一個非常重要的現象,即 FRET 不僅可以在分子內發生,而且還可以在分子間發生。
最近,有學者用 GFP 依賴的生物感測器測量活細胞內生化動力學,通過利用帶有 GFP 標記的蛋白激酶 A 轉染細胞,觀測有關 cAMP 的動態熒光變化。通過融合藍色熒光 GFP 到調節亞單位或融合綠色熒光 GFP 到 PKA 的催化亞單位,設計出了 cAMP 感測器。當 cAMP 濃度很低時,兩個熒光分子距離很近,並出現 FRET,如果增加 cAMP 濃度,發生 FRET 的可能性急劇下降。利用該方法,可以檢測出 cAMP 的動態變化,並開創了在整體條件下,研究 cAMP 調節信號轉導途徑的新方法。
GFP 的結構雖然具有高度完整性,但是實驗中發現,在 GFP 中某些確定的位置,插入外源基因,完全沒有喪失其熒光性。當把 CaM 插入黃色熒光 GFP 突變體中,得到 Ca 2+ 感測器,當 Ca 2+ 結合到 CaM 上,導致生色團去質子化,使熒光強度增加 7 倍。當在黃色熒光 GFP 中插入一個 Zif268 鋅指結構,可以得到傳導 Zn 2+ 的 GFP,結果發現熒光少量增加,為改變前的 1.7 倍,K d 值約 0. 4mmol。插入外源基因致使 GFP 熒光敏感性增強的現象,提供了一個獲取永久編碼感測器去監測細胞信號轉導的新路徑。
光伏發電
瑞典研究人員不再盯著植物作為樣板,轉而將目光投向擁有高超光伏轉化能力的水母,開發出提升收穫太陽能的技術。利用水母身上提取的綠色熒光蛋白(GFP),該小組製作的裝置可用這些“黏黏綠”將紫外光轉化為自由電子。該小組製造的電池由在二氧化硅基底上被一個小縫隔開的兩個簡單的鋁電極組成,GFP置於兩電極中間並起連接作用。當把紫外光放進來的時候,GFP不斷將光子抓走,併產生電子進入電路產生電流。同時,GFP非常廉價,不需要昂貴的添加劑或昂貴的加工,此外,它還能被封裝成獨立的不需要外光源的燃料電池。科學家相信,此能源裝置縮小后可用來驅動微小的納米設備。
神經生物學
神經極性發育
tracking intracellular transport of peptide neurotransmitters using GFP Allen Lab
Enhancer trapping using tau-GFP as reporter localized to axons
其他應用
Cell surface organization in Natural Killer cells Dan Davis
localization of calmodulin in S. pombe with GFP
GFP-plakoglobin and expression plasmids Klymkowsky lab
Molecular Motion Laboratory Yale University
Measuring diacylglycerol in vivo with a GFP-PKC chimera Tobias Meyer
Bentley Lab using GFP for on-line bioprocess monitoring & control
Tracking viral proteins with GFP fusions
GFP vectors and technology
Clontech Inc.Supplier of constructs for making GFP fusions
DeltaVision 3D microscopy platform optimized for imaging GFP in living cells in real time
GFP Expression Truly Amazing Web Site about GFP technology
Universal Imaging Corp. makers of the MetaGFP image processing platform
Quantum Biotechnologies IncSuppliers of GFP and BFP constructs
GFP in Arabidopsis
BabCo/Covance antibody to GFP
Lightools GFP plate illumination systems
GFP in Chlamydomonas
Other Interesting GFP Links
GFP Resources for Teachers
Picture of Aequoria victoria,source of GFP
Structure of green fluorescent proteinFull text of Yang et al Nature Structural Bio paper
Table of GFP mutant forms
Optics in Cell Biology
應用前景
野生型 GFP 合成后需經一定的摺疊過程形成正確構象后才有功能,而且在 470 nm 處的熒光強度相對較低。為了改善 GFP 熒光特性(如摩爾吸收值及釋放波譜),對 GFP 進行了突變和重組實驗。Chalfie 等 通過測定大腸桿菌和線蟲體內重組 GFP 的熒光光譜發現,它和提純的天然 GFP 光譜完全一致。突變實驗發現,多數突變導致 GFP 部分或完全喪失熒光活性,但某種突變使 GFP 明顯地改變激發和釋放波譜。例如用 The 替代 Ser 65,在 490 nm 處出現一個單一激發峰值,激發后產生的熒光強度是野生型的 6 倍,對光淬滅具有更強的抵抗性,並且出現紅移現象,該突變蛋白質與 FITC 的性質相似 ; 同樣 Leu 替代 Phe 64,即增加 GFP 的可溶性,熒光強度增強 35 倍。3 個氨基酸同時突變時,在 360 nm 至 400 nm 之間,出現最大激發峰,而且增大生色團形成的機率,可溶性更強,熒光強度為野生型 GFP 的 18 倍。現有人認為,低濃度 GC 含量是 GFP 低表達的原因之一,為此,研究人員合成了高 GC 含量的特殊 GFP,並且發現這種 GFP 有更強的熒光強度。此外,用人蛋白質中偏愛的密碼子替代相應的野生型 GFP 中密碼子可提高 GFP 在哺乳動物中的表達效率。許多 GFP 突變蛋白,不僅改變了激發和釋放波譜,而且提高生色團形成的效率、溶解度、蛋白質表達等。
不同的突變體給應用提供了更廣闊的前景,但是也發現某些突變體在生理變化的 pH 值範圍內顯示了更大的敏感性。研究人員利用一個 pH 敏感的 GFP 突變體檢測細胞質、細胞核、高爾基體和線粒體基質中的 pH 值,發現在這些區域測量到的數值與以前報道的測量值有非常好的吻合。GFP 依賴的 pH 檢測子,與小分子染料不同,這種檢測手段不必考慮染料滲透、環境水解等一系列問題,且 GFP 具有高度選擇定位性,適合於所有對於基因轉染敏感的細胞。更重要的是,這個實驗說明利用組織特異性啟動子GFP 檢測特定組織,通過融合到目的蛋白,可以檢測特定類型的細胞、細胞器或特定的細胞內區域中的 pH 值。這樣開創了檢測以前所不能到達部位 pH 值的可能性。
熒光蛋白已有非常廣泛的應用,GFP 可應用於轉染細胞的確定,體內基因表達的測定,蛋白質分子的定位和細胞間分子交流的動態監測,免疫分析、核酸鹼基探針分析,以及分子間第二信使鈣離子和 cAMP 水平的指示,細胞間隙pH 變化的檢測。另外,GFP 也可以和其他蛋白質形成融合蛋白,作為基因治療檢測指標。但是,GFP 在應用中還發現有許多問題亟待解決 :⑴熒光信號強度的非線性性質使得定量非常困難,⑵多數生物具有微弱的自發熒光現象,並有著類似的激發和發射波長,這個熒光背景會影響某些 GFP 的檢測,⑶實驗中發現很難建成 GFP 穩定細胞株,可能與 GFP 參與細胞凋亡過程有關,(4)另外,需要注意,由於GFP本身分子量較大,以融合蛋白形式表達的GFP有可能對蛋白本身的細胞定位等特性產生影響,在使用GFP作為標籤時需要進行仔細分析。

2008年諾貝爾化學獎得主
在2008年的諾貝爾化學獎上,綠色熒光蛋白成了主角。諾貝爾獎委員會將化學獎授予美籍日裔科學家下村修、美國科學家馬丁·沙爾菲和美籍華裔科學家錢永健三人,以表彰他們發現和發展了綠色熒光蛋白質技術。在諾貝爾獎新聞發布會的現場,發言人取出一支試管,置於藍光燈之下,只見這支試管中的物質發出了綠色熒光……
2008年的諾貝爾化學獎授予了從事有關“綠色熒光蛋白質的發現,表達和發展”並取得重要成就的三位科學家:下村修、馬丁·查爾菲和錢永健。
2008年諾貝爾自然科學獎頒布后,相關的介紹與報道鋪天蓋地。其中一條新聞很有意思,在諾貝爾化學獎得主下村修的出生地日本,養殖在一家水族館里的一種多管水母也一夜成名,吸引了無數人前來參觀,因為下村修正是從這種水母身上發現了後來讓他獲獎的綠色熒光蛋白。其實下村修本人的經歷,也如同這種水母一樣:作為綠色熒光蛋白的發現者,幾十年來一直默默無聞,甚至他本人當初都沒有預見到該項發現的價值。如果不是後來幾位有技術、工程背景的研究人員在基礎研究和實際應用之間架起橋樑,這項發現恐怕還淹沒在論文堆中。與PCR(聚合酶鏈反應)技術一樣,又一項與生物和生命科學有重要相關的技術獲得了諾貝爾化學獎。