細胞信號轉導
細胞信號轉導
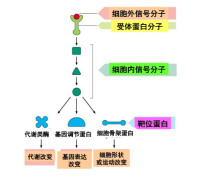
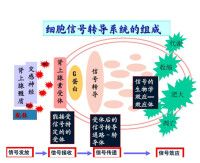
細胞信號轉導是指細胞通過胞膜或胞內受體感受信息分子的刺激,經細胞內信號轉導系統轉換,從而影響細胞生物學功能的過程。水溶性信息分子及前列腺素類(脂溶性)必須首先與胞膜受體結合,啟動細胞內信號轉導的級聯反應,將細胞外的信號跨膜轉導至胞內;脂溶性信息分子可進入胞內,與胞漿或核內受體結合,通過改變靶基因的轉錄活性,誘發細胞特定的應答反應。
細胞信號轉導
高等生物所處的環境無時無刻不在變化,機體功能上的協調統一要求有一個完善的細胞間相互識別、相互反應和相互作用的機制,這一機制可以稱作細胞通訊(Cell Communication)。在這一系統中,細胞或者識別與之相接觸的細胞,或者識別周圍環境中存在的各種信號(來自於周圍或遠距離的細胞),並將其轉變為細胞內各種分子功能上的變化,從而改變細胞內的某些代謝過程,影響細胞的生長速度,甚至誘導細胞的死亡。
這種針對外源性信號所發生的各種分子活性的變化,以及將這種變化依次傳遞至效應分子,以改變細胞功能的過程稱為信號轉導(Signal Transduction),其最終目的是使機體在整體上對外界環境的變化發生最為適宜的反應。在物質代謝調節中往往涉及到神經-內分泌系統對代謝途徑在整體水平上的調節,其實質就是機體內一部分細胞發出信號,另一部分細胞接收信號並將其轉變為細胞功能上的變化的過程。所以,闡明細胞信號轉導的機理就意味著認清細胞在整個生命過程中的增殖、分化、代謝及死亡等諸方面的表現和調控方式,進而理解機體生長、發育和代謝的調控機理。
1.環狀受體(離子通道型受體)
細胞信號轉導
2.蛇型受體
7個跨膜α-螺旋受體,有100多種,都是單條多肽鏈糖蛋白,如G蛋白偶聯型受體。
3.單跨膜α-螺旋受體
包括酪氨酸蛋白激酶型受體和非酪氨酸蛋白激酶型受體。
(1)酪氨酸蛋白激酶型受體這類受體包括生長因子受體、胰島素受體等。與相應配體結合后,受體二聚化或多聚化,表現酪氨酸蛋白激酶活性,催化受體自身和底物Tyr磷酸化,有催化型受體之稱。
(2)非酪氨酸蛋白激酶型受體,如生長激素受體、干擾素受體等,。當受體與配體結合后,可偶聯並激活下游不同的非受體型TPK,傳遞調節信號。
位於胞液或胞核,結合信號分子后,受體表現為反式作用因子,可結合DNA順式作用元件,活化基因轉錄及表達。包括類固醇激素受體、甲狀腺激素受體等。胞內受體都是單鏈蛋白,有4個結構區:①高度可變區②DNA結合區③激素結合區④絞鏈區。
特點是:①高度親和力,②高度特異性,③可飽和性
細胞信號轉導
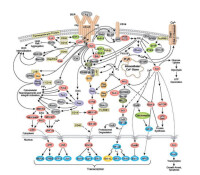
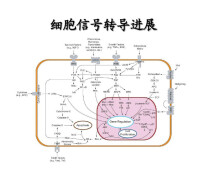
2.G蛋白:即鳥苷酸結合蛋白,是一類位於細胞膜胞漿面、能與GDP或GTP結合的外周蛋白,由α、β、γ三個亞基組成。以三聚體存在並與GDP結合者為非活化型。當α亞基與GTP結合併導致βγ二聚體脫落時則變成活化型,可作用於膜受體的不同激素,通過不同的G蛋白介導影響質膜上某些離子通道或酶的活性,繼而影響細胞內第二信使濃度和後續的生物學效應。
細胞信號轉導
2.受體酪氨酸蛋白激酶(RTPK)信號轉導途徑受體酪氨酸蛋白激酶超家族的共同特徵是受體本身具有酪氨酸蛋白激酶(TPK)的活性,配體主要為生長因子。RTPK途徑與細胞增殖肥大和腫瘤的發生關係密切。配體與受體胞外區結合后,受體發生二聚化后自身具備(TPK)活性並催化胞內區酪氨酸殘基自身磷酸化。RTPK的下游信號轉導通過多種絲氨酸/蘇氨酸蛋白激酶的級聯激活:(1)激活絲裂原活化蛋白激酶(MAPK),(2)激活蛋白激酶C(PKC),(3)激活磷脂醯肌醇3激酶(PI3K),從而引發相應的生物學效應。
3.非受體酪氨酸蛋白激酶途徑此途徑的共同特徵是受體本身不具有TPK活性,配體主要是激素和細胞因子。其調節機制差別很大。如配體與受體結合使受體二聚化后,可通過G蛋白介導激活PLC-β或與胞漿內磷酸化的TPK結合激活PLC-γ,進而引發細胞信號轉導級聯反應。
4.受體鳥苷酸環化酶信號轉導途徑一氧化氮(NO)和一氧化碳(CO)可激活鳥苷酸環化酶(GC),增加cGMP生成,cGMP激活蛋白激酶G(PKG),磷酸化靶蛋白髮揮生物學作用。
5.核受體信號轉導途徑細胞內受體分佈於胞漿或核內,本質上都是配體調控的轉錄因子,均在核內啟動信號轉導並影響基因轉錄,統稱核受體。核受體按其結構和功能分為類固醇激素受體家族和甲狀腺素受體家族。類固醇激素受體(雌激素受體除外)位於胞漿,與熱休克蛋白(HSP)結合存在,處於非活化狀態。配體與受體的結合使HSP與受體解離,暴露DNA結合區。激活的受體二聚化並移入核內,與DNA上的激素反應元件(HRE)相結合或其他轉錄因子相互作用,增強或抑制基因的轉錄。甲狀腺素類受體位於核內,不與HSP結合,配體與受體結合后,激活受體並以HRE調節基因轉錄。
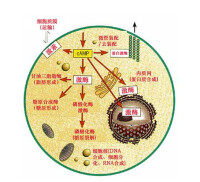
細胞信號轉導
細胞凋亡是一個主動的信號依賴過程,可由許多因素誘導,如放射線照射、缺血缺氧、病毒感染、藥物及毒素等。這些因素大多可通過激活死亡受體而觸發細胞凋亡機制。死亡受體存在於細胞表面。屬於腫瘤壞死因子受體超家族,它們與相應的配體或抗體結合而活化后,其胞漿區即可與一些信號轉導蛋白結合,其中重要的是含有死亡結構域的胞漿蛋白。它們通過死亡結構域一方面與死亡受體相連,另一方面與下游的capase蛋白酶結合,使細胞膜表面的死亡信號傳遞到細胞內。
capase蛋白酶家族作為細胞凋亡的執行者,它們活化後進一步剪切底物,如多聚(ADP-核糖)聚合酶(PARP)該酶與DNA修復及基因完整性監護有關,PARP被剪切后,失去正常的功能,使受其抑制的核酸內切酶活性增高,裂解核小體間的DNA,最終引起細胞凋亡。這個過程可概括為:死亡受體含有死亡結構域的胞漿蛋白—capase蛋白酶家族—底物PARP—染色體斷裂—細胞凋亡。不同種類的細胞在接受不同的細胞外刺激后引起凋亡的形態學改變是高度保守的,但是它們並不是遵循同一種固定的或有規律的模式進行,而是通過各自的信號轉導途徑來傳遞胞膜上的死亡。
細胞信號通路出現故障導致癌症
有2項新的研究對助長正常細胞轉變為2種最致命癌症的基因組的變異進行了描述,它們是多形性膠質母細胞瘤(這是最常見類型的腦癌)和胰腺癌。儘管每種癌症類型的特異性基因組變異每個腫瘤都有所不同,但這2項研究披露了一個核心組的細胞信號通路和調節過程出現了偏差,從而導致了疾病的發生。在第一項研究中,D.Williams Parsons及其同事對來自22個人類膠質母細胞瘤樣本的2萬多個編碼蛋白質的基因序列進行了分析,以期發現可能的變異。另外,他們還觀察那些有著腫瘤特異性變化的基因表達譜以及被拷貝基因的數量。他們發現了多種的影響基因的變異,而這些變異從前並沒有與這些腫瘤掛上鉤。有一種叫做IDH1的基因容易在所謂的“繼發性膠質母細胞瘤”中發生變異,這種繼發性膠質母細胞瘤起源於低度惡性的腫瘤,同時也出現於較年輕的病人中。在這一小型的研究中,病人的腫瘤如果有IDH1變異的話會有較長的生存時間,這表明IDH1基因是一種可用於篩選和治療的有用的臨床標記,儘管這些結果還需要在一個更大的實驗分析中得到證實。在第2項研究中,同一批的科學家對胰腺癌的基因組成進行了調查。胰腺癌是一種常常在發現的時候已經處於晚期的癌症,而且對這種癌症的治療方法十分匱乏。
SianJones及其同事對24例人類胰腺腫瘤的樣本應用了相同的基因組策略,他們報道說,有一核心組的12種細胞信號通路或調節過程在70-100%的這些腫瘤中都逐一出現了基因變異,表明這些通路的中斷是胰腺腫瘤發展的重大特徵的形成原因。文章的作者得出結論:“治療研發的最大希望可能是發現以變異通路和過程的生理效應作為標靶的藥物,而不是針對它們的個別基因組分的藥物。”
美國新技術可直接將神經信號變為聲音。
美國科學家研製出了一套充滿科幻色彩的技術--可以將大腦神經系統產生的電脈衝轉換為聲音信號。研究人員藉助植入大腦中的電極已經能夠將人意識中出現的單個母音字母轉換為聲音。他們認為,今後,這項技術將可以使那些全身癱瘓的人與其他人進行正常交流。
參與試驗的志願者是一位28歲的英國人,名叫埃里克·拉姆齊。由於受到嚴重的外傷,他已完全癱瘓長達9年的時間。他只能通過眼神與醫生和親人進行交流。2004年,這位年輕人的大腦中被植入了一個電極。通過分析神經細胞的活動模式,科學家們學會了如何區分患者意識中想到的單個聲音。在現階段的試驗中,對單個母音字母的識別準確率已可以達到80%。今後,研究人員還將嘗試識別單個的字母,之後是完整的句子。據悉,整個“朗讀意識”的過程可在實時狀態下進行,這將使得患者的想法更容易被設備所識別。
