高氯酸根
高氯酸根
高氯酸根 ClO4-
在高氯酸根中,氯元素呈現+7價,按照化學價的意義,氯原子對電子有很強的吸引能力,即很容易得電子,因此具有氧化性。
HClO 次氯酸
HClO2 亞氯酸
HClO3 氯酸
HClO4 高氯酸 六大無機強酸之一
在氯的含氧酸根中氧化性最弱
中心Cl發生sp3雜化,形成4個sp3雜化軌道,7個電子,其中3對填充在3個雜化軌道上(記為雜化軌道A),最後1個雜化軌道只有一個電子(記為雜化軌道B)。4個O中,一個連接了H原子,這個O還剩1個2p軌道,這個軌道與Cl的雜化軌道B重疊,形成一個共價單鍵。剩下的3個O,發生電子重排,6個電子挪到3個軌道上,空出1個2p軌道,然後與Cl的雜化軌道A形成3個配位鍵。
也就是說,HClO4分子結構如下,箭頭表示配位鍵。
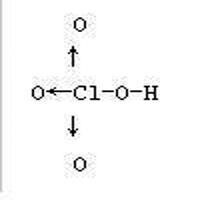
高氯酸根
高氯酸根比次氯酸根的氧化性弱
按照一般規律,同種元素,處於高價態的氧化性高於處於低價態的。
次氯酸具有強氧化性,是因為①+1價的氯元素本身氧化性很強;②次氯酸易分解,新產生的氧氣(氧自由基)具有超強氧化性。
所以高氯酸根比次氯酸根的氧化性弱。