雜化軌道
1931年鮑林提出的化學理論
雜化軌道理論(Hybrid Orbital Theory)是1931年由鮑林(Pauling L)等人在價鍵理論的基礎上提出,它實質上仍屬於現代價鍵理論,但是它在成鍵能力、分子的空間構型等方面豐富和發展了現代價鍵理論。
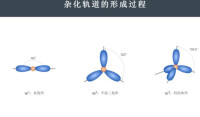
雜化軌道
2.雜化軌道的角度函數在某個方向的值比雜化前的大得多,更有利於原子軌道間最大程度地重疊,因而雜化軌道比原來軌道的成鍵能力強(軌道是在雜化之後再成鍵)。
3.雜化軌道之間力圖在空間取最大夾角分佈,使相互間的排斥能最小,故形成的鍵較穩定。不同類型的雜化軌道之間夾角不同,成鍵后所形成的分子就具有不同的空間構型。
4.只有最外電子層中不同能級中的電子可以進行軌道雜化,且在第一層的兩個電子不參與反應。
5.不同能級中的電子在進行軌道雜化時,電子會從能量低的層躍遷到能量高的層,並且雜化以後的各電子軌道能量相等又高於原來的能量較低的能級的能量而低於原來能量較高的能級的能量。當然的,有幾個原子軌道參加雜化,雜化后就生成幾個雜化軌道。
6.雜化軌道成鍵時,要滿足原子軌道最大重疊原理。
雜化后的電子軌道與原來相比在角度分佈上更加集中,從而使它在與其他原子的原子軌道成鍵時重疊的程度更大,形成的共價鍵更加牢固。
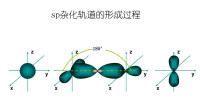
雜化軌道
,按雜化后形成的幾個雜化軌道的能量是否相同,軌道的雜化可分為等性和不等性雜化。
於1931年,鮑林提出
一個原子中的幾個原子軌道經過再分配而組成的互相等同的軌道。原子在化合成分子的過程中,根據原子的成鍵要求,在周圍原子影響下,將原有的原子軌道進一步線性組合成新的原子軌道。這種在一個原子中不同原子軌道的線性組合,稱為原子軌道的雜化。雜化后的原子軌道稱為雜化軌道。雜化時,軌道的數目不變,軌道在空間的分佈方向和分佈情況發生改變。組合所得的雜化軌道一般均和其他原子形成較強的σ鍵或安排孤對電子,而不會以空的雜化軌道的形式存在。在某個原子的幾個雜化軌道中,全部由成單電子的軌道參與的雜化,稱為等性雜化軌道;有孤對電子參與的雜化,稱為不等性雜化軌道。
雜化軌道具有和s,p等原子軌道相同的性質,必須滿足正交,歸一性。
價鍵理論對共價鍵的本質和特點做了有力的論證,但它把討論的基礎放在共用一對電子形成一個共價鍵上,在解釋許多分子、原子的價鍵數目及分子空間結構時卻遇到了困難。例如C原子的價電子是,按電子排布規律,2個s電子是已配對的,只有2個p電子未成對,而許多含碳化合物中C都呈4價而不是2價,可以設想有1個s電子激發到p軌道去了。那麼1個s軌道和3個p軌道都有不成對電子,可以形成4個共價鍵,但s和p的成鍵方向和能量應該是不同的。而實驗證明:分子中,4個共價鍵是完全等同的,鍵長為,鍵角為。等許多分子也都有類似的情況。為了解釋這些矛盾,1928年Pauling提出了雜化軌道概念,豐富和發展了的價鍵理論。他根據量子力學(Quantum Mechenical)的觀點提出:在同一個原子中,能量相近的不同類型的幾個原子軌道在成鍵時,可以互相疊加重組,成為相同數目、能量相等的新軌道,這種新軌道叫雜化軌道。
C原子中1個2s電子激發到2p后,1個2s軌道和3個2p軌道重新組合成4個雜化軌道,它們再和4個H原子形成4個相同的鍵,C位於正四面體的中心,4個H位於四個頂角。
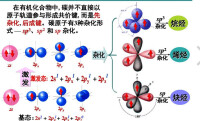
雜化軌道
這3個雜化軌道中有2個軌道分別與2個H原子形成σ單鍵,還有1個軌道則與另一個C的軌道形成頭對頭的σ鍵,同時位於垂直方向的pz軌道則以肩並肩的方式形成了π鍵。也就是說碳碳雙鍵是由一個σ鍵和一個π鍵組成,即雙鍵中兩個鍵是不等同的。π鍵原子軌道的重疊程度小於σ鍵,π鍵不穩定,容易斷裂,所以含有雙鍵的烯烴很容易發生加成反應,如乙烯()和氯()反應生成氯乙烯()。
乙炔分子()中有碳碳三鍵(HC≡CH)VSEPR(Valence-Shell Electron-Pair Repulsion)(價電子層互斥模型) 通過成鍵電子對數與孤電子(Lone Pair Electron)對數可判斷中心原子雜化模型,成鍵電子對數:ABn中n的值;孤電子對數:(A價電子數-A成鍵電子數)/2。
價電子對總數即兩者之和,如價電子對總數為2時為sp雜化(直線形),為3時為雜化(平面三角形),為4時為雜化(四面體)(三角雙錐),(八面體)。而成鍵電子對數與孤電子對數的不同使得分子的幾何構型不同。
軌道的相互疊加過程叫原子軌道的雜化。原子軌道疊加后產生的新的原子軌道叫雜化軌道。
⑴ 在形成分子(主要是化合物)時,同一原子中能量相近的原子軌道 (一般為同一能級組的原子軌道) 相互疊加(雜化)形成一組的新的原子軌道。
⑵ 雜化軌道比原來的軌道成鍵能力強,形成的化學鍵鍵能大,使生成的分子更穩定。由於成
鍵原子軌道雜化后,軌道角度分布圖的形狀發生了變化(形狀是一頭大,一頭小),雜化軌道在某些方向上的角度分佈,比未雜化的p軌道和s軌道的角度分佈大得多,它的大頭在成鍵時與原來的軌道相比能夠形成更大的重疊,因此雜化軌道比原有的原子軌道成鍵能力更強。
⑶ 形成的雜化軌道之間應儘可能地滿足最小排斥原理(化學鍵間排斥力越小,體系越穩定),為滿足最小排斥原理,雜化軌道之間的夾角應達到最大。
⑷ 分子的空間構型主要取決於分子中σ鍵形成的骨架,雜化軌道形成的鍵為σ鍵,所以,雜化軌道的類型與分子的空間構型相關。
(1)sp雜化
同一原子內由一個ns軌道和一個np軌道發生的雜化,稱為sp雜化。雜化后組成的軌道稱為sp雜化軌道。sp雜化可以而且只能得到兩個sp雜化軌道。實驗測知,氣態中的鈹原子就是發生sp雜化,它是一個直線型的共價分子。Be原子位於兩個Cl原子的中間,鍵角,兩個鍵的鍵長和鍵能都相等。
(2)雜化
同一原子內由一個ns軌道和二個np軌道發生的雜化,稱為雜化。雜化后組成的軌道稱為雜化軌道。氣態氟化硼()中的硼原子就是雜化,具有平面三角形的結構。B原子位於三角形的中心,三個B-F鍵是等同的,鍵角為。
(3)雜化
同一原子內由一個ns軌道和三個np軌道發生的雜化,稱為雜化,雜化后組成的軌道稱為雜化軌道。雜化可以而且只能得到四個雜化軌道。分子中的碳原子就是發生雜化,它的結構經實驗測知為正四面體結構,四個鍵均等同,鍵角為。這樣的實驗結果,是電子配對法所難以解釋的,但雜化軌道理論認為,激發態C原子()的2s軌道與三個2p軌道可以發生雜化,從而形成四個能量等同的雜化軌道。
(4)雜化
等性雜化為三角雙錐結構,如
(5)雜化
等性雜化為正八面體結構,如
說明:以上只是常見的雜化軌道類型,在配位化合物中還有更多的雜化類型。
“頭碰頭”的方式重疊成σ鍵,“肩並肩”的方式重疊為π鍵
例如在乙烯()分子中有碳碳雙鍵(),碳原子的激發態中和2s形成雜化軌道,這3個軌道能量相等,位於同一平面並互成夾角,另外一個pz軌道未參與雜化,位於與平面垂直的方向上。碳碳雙鍵中的雜化如下所示。
乙炔分子()中有碳碳叄鍵(),激發態的C原子中2s和2px軌道形成sp雜化軌道。這兩個能量相等的sp雜化軌道在同一直線上,其中之一與H原子形成σ單鍵,另外一個sp雜化軌道形成C原子之間的σ鍵,而未參與雜化的py與pz則垂直於x軸並互相垂直,它們以肩並肩的方式與另一個C的py,pz形成π鍵。即碳碳三鍵是由一個σ鍵和兩個π鍵組成。這兩個π鍵不同於σ鍵,軌道重疊也較少並不穩定,因而容易斷開,所以含三鍵的炔烴也容易發生加成反應。
雜化軌道限於最外層電子,而在第一層的兩個電子不參與反應,而在其他層上有許多的軌道,電子會從能量低的層“躍遷”到能量高的層,而原來能量低的層是因為電子的運動方向相反,而躍遷以後電子就只向一種方向運動,所以能量會高。並且反應以後組成的能量介於原來的S軌道和P軌道能量之間。
幾種雜化軌道之後的分子空間形態
sp雜化:直線型
雜化:平面三角形(等性雜化為平面正三角形)
雜化:空間四面體(等性雜化為正四面體)
1、判斷中心原子的孤對電子對數
2.找出與中心原子相連的原子數(即形成的σ鍵的數量)
3.若二者相加等於2,那麼中心原子採用SP雜化;若等於3,那麼中心原子採用雜化;若等於4,那麼中心原子採用雜化。
【如乙烯,碳原子為中心原子,與其連接的原子數為3,同時碳的4個價電子均成鍵(3個σ鍵加1個π鍵),故孤對電子對數為零,所以,採取雜化;如氧化氫,氧原子為中心原子,與氧原子相連的原子數為2,同時氧剩餘兩對孤對電子,所以,採用雜化。】
說白了,最初原子軌道的雜化概念完全是人造的。是為了解釋--四面體這類的現象。後來分子軌道理論出現,原子軌道的雜化就自然而然的被解釋了---只不過是一種同原子的原子軌道的重新線性組合。同時,分子軌道理論也表明了這種組合(雜化)沒有實際上的意義,而且有時會引起混亂。譬如:在雜化理論中,中的八個成鍵電子是在同一種軌道能級上. 但其實,它們是分在兩個不同的能級上的(試驗和分子軌道理論都表明了這一點)。但是由於雜化概念的方便,特別是在有機化學中被用來表示一個原子在分子中的幾何環境。時至今日,雜化軌道僅被用來描述幾何形狀或環境。
除此之外,過分地強調雜化的其他“重要性”都會對未來學習化學造成不必要的“彎路”。(不幸的是許多中學老師還在這樣做)。
實驗證明,甲烷分子是正四面體構型,鍵角為,四個C—H鍵完全等同。碳原子C的基組態是,只有兩個未成對電子,按價鍵理論電子自旋反平行配對成鍵,它只能形成兩個C—H鍵,不能解釋CH_4中C生成四個C—H鍵的事實。如果一個2s電子激發到2px軌道上,即
這樣就有四個未成對電子,可形成四個C—H鍵,從而解釋了中C生成四個鍵的事實。但是我們已經知道,p軌道的成鍵能力大於s軌道的成鍵能力,這就是說三個p軌道形成的三個C—H鍵強於由一個s軌道形成的一個鍵,使四個鍵不等同。並且三個互相垂直的,軌道和一個球形的s軌道與H形成的四個鍵,其鍵角也決不是。因此,仍不能解釋分子的構型。解決這一問題的唯一方法是消除p軌道和s軌道之同的差別,為此三個p軌道和一個s軌道必須混合起來組成新的原子軌道,它們分別指向四面體的四個頂點,而且均為單佔據軌道,再與H的1s電子配對成鍵,即可完滿地解釋分子的幾何構型。
這種在一個原子中不同類型的原子軌道混合成新軌道的過程稱為原子軌道的雜化,所得的新原子軌道稱為雜化軌道。
再從能量方面來分析這一問題。C的2s電子激發到2p軌道上所需要的能量為,而的鍵的鍵能為。這就是說,形成四個鍵放出的能量除補償電子激發所需能星外,還余大量能使穩定存在的能量。分子的幾何構型能被解釋和分子能量低而穩定的事實都給雜化軌道理論提供了實驗依據。
