共找到2條詞條名為脂質體的結果 展開
- 抗腫瘤藥物的理想傳輸載體
- 囊泡
脂質體
抗腫瘤藥物的理想傳輸載體
徠脂質體(liposome)是一種人工膜。在水中磷脂分子親水頭部插入水中,脂質體疏水尾部伸向空氣,攪動后形成雙層脂分子的球形脂質體,直徑25~1000nm不等。脂質體可用於轉基因,或製備的藥物,利用脂質體可以和細胞膜融合的特點,將藥物送入細胞內部生物學定義:當兩性分子如磷脂和鞘脂分散於水相時,分子的疏水尾部傾向於聚集在一起,避開水相,而親水頭部暴露在水相,形成具有雙分子層結構的的封閉囊泡,稱為脂質體。藥劑學定義脂質體(liposome):系指將藥物包封於類脂質雙分子層內而形成的微型泡囊體。
脂質體的分類
1、脂質體按照所包含類脂質雙分子層的層數不同,分為單室脂質體和多室脂質體。
小單室脂質體(SUV):粒徑約0.02~0.08um;大單室脂質體(LUV)為單層大泡囊,粒徑在0.1~lum。
多層雙分子層的泡囊稱為多室脂質體(MIV),粒徑在1~5um之間。
2、按照結構分:單室脂質體,多室脂質體,多囊脂質體。
3、按照電荷分:中性脂質體,負電荷脂質體,正電荷脂質體。
4、按照性能分:一般脂質體,特殊功效脂質體。
脂質體的組成與結構
脂質體的組成:類脂質(磷脂)及附加劑。
1、磷脂類:包括天然磷脂和合成磷脂二類。磷脂的結構特點為一個磷酸基和一個季銨鹽基組成的親水性基團,以及由兩個較長的烴基組成的親脂性基團。
天然磷脂以卵磷脂(磷脂醯膽鹼,PC)為主,來源於蛋黃和大豆,顯中性。
合成磷脂主要有DPPC(二棕櫚醯磷脂醯膽鹼)、DPPE(二棕櫚醯磷脂醯乙醇胺)、DSPC(二硬脂醯磷脂醯膽鹼)等,其均屬氫化磷脂類,具有性質穩定,抗氧化性強,成品穩定等特點,是國外首選的輔料。
2、膽固醇:膽固醇與磷脂是共同構成細胞膜和脂質體的基礎物質。膽固醇具有調節膜流動性的作用,故可稱為脂質體“流動性緩衝劑”。
1、靶向性和淋巴定向性:肝、脾網狀內皮系統的被動靶向性。用於肝寄生蟲病、利什曼病等單核-巨噬細胞系統疾病的防治。如肝利什曼原蟲葯銻酸葡胺脂質體,其肝中濃度比普通製劑提高了200~700倍。
2、緩釋作用:緩慢釋放,延緩腎排泄和代謝,從而延長作用時間。
3、降低藥物毒性:如兩性黴素B脂質體可降低心臟毒性。
4、提高穩定性:如胰島素脂質體、疫苗等可提高主葯的穩定性。
1、形態、粒徑及其分佈
採用掃描電鏡、激光散射法或激光掃描法測定。根據給葯途徑不同要求其粒徑不同。脂質體如注射給葯脂質體的粒徑應小於200nm,且分佈均勻,呈正態性,跨距宜小。
2、包封率和載藥量
包封率:包封率=(脂質體中包封的藥物/脂質體中藥物總量)×100%
一般採用葡聚糖凝膠、超速離心法、透析法等分離方法將溶液中遊離藥物和脂質體分離,分別測定,計算包封率。通常要求脂質體的藥物包封率達80%以上。
載藥量:載藥量=[脂質體中藥物量/(脂質體中藥物+載體總量)]×100%
載藥量的大小直接影響到藥物的臨床應用劑量,故載藥量愈大,愈易滿足臨床需要。載藥量與藥物的性質有關,通常親脂性藥物或親水性藥物較易製成脂質體。
3、脂質體的穩定性
1)、物理穩定性:主要用滲漏率表示。
滲漏率=(放置前介質中藥物量-放置后介質中的藥量)/製劑中藥量x100%
膽固醇可以加固脂質雙分子層膜,降低膜流動,可減小滲漏率。
2)、化學穩定性:
(1)磷脂氧化指數:氧化指數=A233nm/A215nm;一般規定磷脂氧化指數應小於0.2。
(2)磷脂量的測定:基於每個磷脂分子中僅含1個磷原子,採用化學法將樣品中磷脂轉變為無機磷后測定磷摩爾量(或重量),即可推出磷脂量。
4、防止氧化的措施:
防止氧化的一般措施有充入氮氣,添加抗氧劑-生育酚、金屬絡合劑等;也可直接採用氫化飽和磷脂。
5、脂質體的滅菌:
滅菌的一般方法有過濾除菌、無菌操作、-射線照射(60鈷15~20kGy)、121℃熱壓滅菌等。
注入法、薄膜分散法、超聲波分散法、逆向蒸發法。
脂質體作為藥物載體的臨床應用
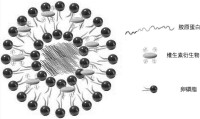
脂質體
2、抗寄生蟲藥物載體:苯硫咪唑脂質體和阿苯達唑脂質體等。利用脂質體的被動靶向性,提高藥物的生物利用度,減少用量,降低毒副作用。
3、抗菌藥物載體:慶大黴素脂質體和兩性黴素B,可減少藥物的耐藥性,降低心臟毒性。
4、激素類藥物載體。
給葯途徑
脂質徠體的給葯途徑主要包括(1)靜脈注射;(2)肌內和皮下注射;(3)口服給葯;(4)眼部給葯;(5)肺部給葯;(6)經皮給葯;(7)鼻腔給葯。
體內過程
脂質體與細胞之間作用的主要形式包括膜間轉運(細胞膜的脂質交換)、接觸釋葯、吸附、融合和內吞。
脂質體具有類細胞結構,進入體內主要被網狀內皮系統吞噬而激活機體自身的免疫功能,並改變包封藥物的體內分佈,使藥物主要在肝、脾、肺和骨髓等組織器官中積蓄,從而提高藥物的治療指數、減少藥物的治療劑量和降低藥物的毒性。
新型靶向脂質體
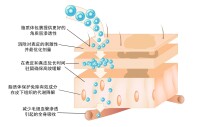
脂質體
合糖類(增加脂質分散面積)製成前體脂質體,遇水時脂質溶脹,載體溶解形成多層脂質體,其中載體的大小直接影響脂質體的大小和均勻性。前體脂質體可預防脂質體之間相互聚集,且更適合包封脂溶性藥物。
2、長循環脂質體:經過PEG修飾,以增加脂質體的柔順性和親水性,通過單核-巨噬細胞系統吞噬,減少脂質體脂膜與血漿蛋白的相互作用,延長循環時間,稱為長循環脂質體(long-circulating liposome)。長循環脂質體有利於肝脾以外的組織或器官的靶向作用。同時,將抗體或配體結合在PEG的末端,既可保持長循環,又可保持對靶體的識別。
3、免疫脂質體:脂質體表面聯接抗體,對靶細胞進行識別,提高脂質體的靶向性。如在絲裂黴素(MMC)脂質體上結合抗胃癌細胞表面抗原的單克隆抗體3G製成免疫脂質,在體內該免疫脂質體對胃癌靶細胞的M85殺傷作用比遊離MMC提高4倍。
4、熱敏脂質體:利用在相變溫度時,脂質體的類脂質雙分子層膜從膠態過渡到液晶態,脂質膜的通透性增加,藥物釋放速度增大的原理製成熱敏脂質體。例如將二棕櫚酸磷脂(DPPC)和二硬脂酸磷脂(DSPC)按一定比例混合,製成的3H甲氨喋呤熱敏脂質體,再注入荷Lewis肺癌小鼠的尾靜脈后,再用微波加熱腫瘤部位至42℃,病灶部位的放射性強度明顯的高於非熱敏脂質體對照組。
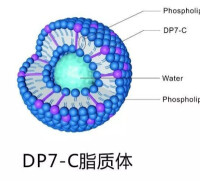
脂質體
總之,脂質體作為藥物載體是臨床應用較早,發展最為成熟的一類新型靶向製劑。美國FDA批准上市的脂質體產品有兩性黴素B、阿黴素脂質體。批准進入臨床試驗的脂
質體有丁胺卡鈉黴素。未來脂質體的研究主要集中在以下三個方面:
1、膜結構與載藥性質之間的關係;
2、脂質體在體內的靶向特性;
3、在體外培養中將基因和其他物質導入細胞內有望成為基因藥物載體。
脂質體是由脂雙分子層組成的顆粒,可介導基因穿過細胞膜。通過脂質體介導比利用病毒轉導進行基因轉移具有以下明顯的優勢:①脂質體與基因的複合過程比較容易;②易於大量生產;③脂質體是非病毒性載體,與細胞膜融合將目的基因導入細胞后,脂質即被降解,無毒,無免疫原性;④DNA或RNA可得到保護,不被滅活或被核酸酶降解;⑤脂質體攜帶的基因可能轉運至特定部位;⑥體外和體內試驗都表明,接近染色體大小的DNA片段也能被轉運至宿主基因組中並增長;⑦轉染過程方便易行,重現性好。
脂質體是具有雙層膜的封閉式粒子,自身聚集性脂類分子包封內水相介質,可分為大、小多層,寡多層和單室脂質體,醫學應用較多為小單室脂質體。基於脂質體作為藥物載體系統的經驗,理想的用於轉運基因的脂質體,對於質粒DNA具有高包封率,保護DNA不被血漿核酶降解的特點,它們粒徑分佈範圍窄,粒徑平均為100nm或者更小。為使脂質體接近血管外區域,故採用具有廣泛的結合潛力脂類,這種特殊脂類可促進與細胞膜融合和/或提高脂質體在循環系統中的穩定性。第1種為傳統上的脂質體,人們可控制其體外行為,但不能控制其體內行為,它們很快被滅活或被固定;第2種為無活性脂質體(即不與外界作用),由於聚合物包封於表面的立體穩定性而抑制其相互作用;第3種脂質體表面結合抗原、凝集素或其他基團,由於表面結合的特定配基,也可特定地相互作用;第4種為反應活性脂質體,如離子型、靶敏感型和融合性脂質體,這種脂質體有時指相轉變的多孔脂質體,脂質體內有離子敏感亞基,Ca2+其他金屬離子敏感性脂質體,也包括陽離子脂質體,陰離子脂質體。陰離子脂質體不屬於有反應活性類,但特殊的試驗如試管內與相反電荷(多)離子相互作用例子除外。
常規脂質體進入細胞轉運DNA實驗,其原理是脂質體增強細胞體的聚集,即加速大分子、荷電多的分子透過膜,該過程相當複雜,尤其在包封較大片段時,在實踐中這種技術只在體外使用且要用融合劑,荷電越多用途越少。
