氫鍵
一種次級鍵名稱
氫原子與電負性大的原子X以共價鍵結合,若與電負性大、半徑小的原子Y(O F N等)接近,在X與Y之間以氫為媒介,生成X-H…Y形式的一種特殊的分子間或分子內相互作用,稱為氫鍵。[X與Y可以是同一種類分子,如水分子之間的氫鍵;也可以是不同種類分子,如一水合氨分子(NH3·H2O)之間的氫鍵]。
在蛋白質的a-螺旋的情況下是N-H…O型的氫鍵,DNA的雙螺旋情況下是N-H…O,N-H…N型的氫鍵,因為這些結構是穩定的,所以這樣的氫鍵很多。此外,水和其他溶媒是異質的,也由於在水分子間生成O-H—…O型氫鍵。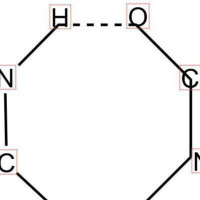 因此,這也就成為疏水結合形成的原因。
因此,這也就成為疏水結合形成的原因。

氫鍵
(1)存在與電負性很大的原子A 形成強極性鍵的氫原子。
(2)存在 較小半徑、較大電負性、含孤對電子、帶有部分負電荷的原子B (F、O、N)
氫鍵的本質: 強極性鍵(A-H)上的氫核 與電負性很大的、含孤電子對並帶有部分負電荷的原子B之間的靜電作用力。
(3)表示氫鍵結合的通式
氫鍵結合的情況如果寫成通式,可用X-H…Y表示。式中X和Y代表F,O,N等電負性大而原子半徑較小的非金屬原子。
X和Y可以是兩種相同的元素,也可以是兩種不同的元素。
(4)對氫鍵的理解
氫鍵存在雖然很普遍,對它的研究也在逐步深入,但是人們對氫鍵的定義至今仍有兩種不同的理解。
第一種把X-H…Y整個結構叫氫鍵,因此氫鍵的鍵長就是指X與Y之間的距離,例如F-H…F的鍵長為255pm。
第二種把H…Y叫做氫鍵,這樣H…F之間的距離163pm才算是氫鍵的鍵長。這種差別,我們在選用氫鍵鍵長數據時要加以注意。
不過,對氫鍵鍵能的理解上是一致的,都是指把X-H…Y-H分解成為HX和HY所需的能量。
(5)氫鍵的飽和性和方向性
氫鍵不同於范德華力,它具有飽和性和方向性。由於氫原子特別小而原子A和B比較大,所以A—H中的氫原子只能和一個B原子結合形成氫鍵。同時由於負離子之間的相互排斥,另一個電負性大的原子B′就難於再接近氫原子,這就是氫鍵的飽和性。
氫鍵具有方向性則是由於電偶極矩A—H與原子B的相互作用,只有當A—H…B在同一條直線上時最強,同時原子B一般含有未共用電子對,在可能範圍內氫鍵的方向和未共用電子對的對稱軸一致,這樣可使原子B中負電荷分佈最多的部分最接近氫原子,這樣形成的氫鍵最穩定。
氫鍵通常可用X-H…Y來表示。其中X以共價鍵(或離子鍵)與氫相連,具有較高的電負性,可以穩定負電荷,因此氫易解離,具有酸性(質子給予體)。而Y則具有較高的電子密度,一般是含有孤對電子的原子,容易吸引氫質子,從而與X和H原子形成三中心四電子鍵。
成鍵原子
典型的氫鍵中,X和Y是電負性很強的F、N和O原子。但C、S、Cl、P甚至Br和I原子在某些情況下也能形成氫鍵,但通常鍵能較低。碳在與數個電負性強的原子相連時也有可能產生氫鍵。例如在氯仿CHCl3中,碳原子直接與三個氯原子相連,氯原子周圍電子云密度較大,因而碳原子周圍即帶有部分正電荷,碳也因此參與了氫鍵的形成,扮演了質子供體的角色。此外,芳環上的碳也有相對強的吸電子能力,因此形成Ar-H … :O型的弱氫鍵(此處Ar表示芳環)。芳香環、碳碳叄鍵或雙鍵在某些情況下都可作為電子供體,與強極性的X-H(如-O-H)形成氫鍵。
同種分子之間
現以HF為例說明氫鍵的形成。在HF分子中,由於F的電負性(4.0)很大,共用電子對強烈偏向F原子一邊,而H原子核外只有一個電子,其電子云向F原子偏移的結果,使得它幾乎要呈質子狀態。這個半徑很小、無內層電子的帶部分正電荷的氫原子,使附近另一個HF分子中含有負電子對並帶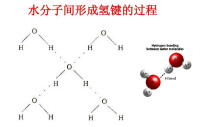 部分負電荷的F原子有可能充分靠近它,從而產生靜電吸引作用。這個靜電吸引作用力就是所謂氫鍵。即F-H...F。
部分負電荷的F原子有可能充分靠近它,從而產生靜電吸引作用。這個靜電吸引作用力就是所謂氫鍵。即F-H...F。

氫鍵
不同種分子之間
分子內氫鍵
某些分子內,例如HNO3、鄰硝基苯酚分子可以形成分子內氫鍵,還有一個苯環上連有兩個羥基,一個羥基中的氫與另一個羥基中的氧形成氫鍵。分子內氫鍵由於受環狀結構的限制,X-H…Y往往不能在同一直線上。分子內氫鍵使物質熔沸點降低。分子內氫鍵必須具備形成氫鍵的必要條件,還要具有特定的條件,如:形成平面環,環的大小以五或六原子環最穩定,形成的環中沒有任何的扭曲。
雙氫鍵與Π氫鍵
不同分子之間還可能形成雙氫鍵效應,寫為B-H… H-A。比如H3N - BH3,而雙氫鍵很容易脫去H2,所以雙氫鍵也被看成氫化物脫氫的中間體。另外在大分子中往往還存在π—氫鍵,大π鍵或離域π 鍵體系具有較大的電子云可以作為質子的受體,而形成π—氫鍵,也稱芳香氫鍵,在穩定多肽和蛋白質中也起著重要作用。如圖所示在CAP - DNA 複合物中,苯丙氨酸的芳香環和胞嘧啶形成芳香氫鍵。
氫鍵的結合能是2—8千卡(Kcal)。氫鍵是一種比分子間作用力(范德華力)稍強,比共價鍵和離子鍵弱很多的相互作用。其穩定性弱於共價鍵和離子鍵。
氫鍵鍵能大多在25-40kJ/mol之間。一般認為鍵能<25kJ/mol的氫鍵屬於較弱氫鍵,鍵能在25-40kJ/mol的屬於中等強度氫鍵,而鍵能>40kJ/mol的氫鍵則是較強氫鍵。曾經有一度認為最強的氫鍵是[HF2]中的FH…F鍵,計算出的鍵能大約為169kJ/mol。而事實上,用相同方法計算甲酸和氟離子間的[HCO2H…F]氫鍵鍵能,結果要比HF2的高出大約30kJ/mol。
常見氫鍵的平均鍵能數據為:
F—H … :F (155 kJ/mol 或 40 kcal/mol)
O—H … :N (29 kJ/mol 或 6.9 kcal/mol)
O—H … :O (21 kJ/mol 或 5.0 kcal/mol)
N—H … :N (13 kJ/mol 或 3.1 kcal/mol)
N—H … :O (8 kJ/mol 或 1.9 kcal/mol)
HO—H … :OH3(18 kJ/mol或 4.3 kcal/mol)
氫鍵通常是物質在液態時形成的,但形成後有時也能繼續存在於某些晶態甚至氣態物質之中。例如在氣態、液態和固態的HF中都有氫鍵存在。能夠形成氫鍵的物質是很多的,如水、水合物、氨合物、無機酸和某些有機化合物。氫鍵的存在,影響到物質的某些性質。
分子間有氫鍵的物質熔化或氣化時,除了要克服純粹的分子間力外,還必須提高溫度,額外地供應一份能量來破壞分子間的氫鍵,所以這些物質的熔點、沸點比同系列氫化物的熔點、沸點高。
分子內生成氫鍵,熔、沸點常降低。因為物質的熔沸點與分子間作用力有關,如果分子內形成氫鍵,那麼相應的分子間的作用力就會減少, 分子內氫鍵會使物質熔沸點降低。例如有分子內氫鍵的鄰硝基苯酚熔點(45℃)比有分子間氫鍵的間位熔點(96℃)和對位熔點(114℃)都低。
在極性溶劑中,如果溶質分子與溶劑分子之間可以形成氫鍵,則溶質的溶解度增大。HF和NH3在水中的溶解度比較大,就是這個緣故。
分子間有氫鍵的液體,一般粘度較大。例如甘油、磷酸、濃硫酸等多羥基化合物,由於分子間可形成眾多的氫鍵,這些物質通常為粘稠狀液體。
液體分子間若形成氫鍵,有可能發生締合現象,例如液態HF,在通常條件下,除了正常簡HF分子外,還有通過氫鍵聯繫在一起的複雜分子(HF)n。 nHF(HF)n 。其中n可以是2,3,4…這種由若干個簡單分子聯成複雜分子而又不會改變原物質化學性質的現象,稱為分子締合。分子締合的結果會影響液體的密度。
氫鍵對化合物熔點和沸點的影響
分子間形成氫鍵時,化合物的熔點、沸點顯著升高。HF,H20和NH3等第二周期元素的氫化物,由於分子間氫鍵的存在,要使其固體熔化或液體氣化,必須給予額外的能量破壞分子間的氫鍵,所以它們的熔點、沸點均高於各自同族的氫化物。
值得注意的是,能夠形成分子內氫鍵的物質,其分子間氫鍵的形成將被削弱,因此它們的熔點、沸點不如只能形成分子間氫鍵的物質高。硫酸、磷酸都是高沸點的無機強酸,但是硝酸由於可以生成分子內氫鍵的原因,卻是揮發性的無機強酸。可以生成分子內氫鍵的鄰硝基苯酚,其熔點遠低於它的同分異構體對硝基苯酚。
由於具有靜電性質和定向性質,氫鍵在分子形成晶體的堆積過程中有一定作用。尤其當體系中形成較多氫鍵時,通過氫鍵連接成網路結構和多維結構在晶體工程學中有重要意義。
氫鍵與分子間作用力概念辨析
關於氫鍵,論壇爭論最多的在於不同筆者對氫鍵與分子間作用力從屬關係的爭論。
傳統定義,將分子間作用力定義為:“分子的永久偶極和瞬間偶極引起的弱靜電相互作用”。隨著研究的深入,發現了許多用現有分子間作用力的作用機理無法說明的現象。比如鹵鍵,有機汞鹵化物時觀察到分子內鹵素原子與汞原子之間存在長距離弱的共價相互作用力,從而引入二級價鍵力(secondary valence forces)的概念。
現在學術上,已經不再用“分子間作用力”來涵蓋全部的弱相互作用,而是用更準確術語“次級鍵”。氫鍵、范德華力、鹽鍵、疏水作用力、芳環堆積作用、鹵鍵都統稱為“次級鍵”。
氫鍵是否屬於分子間作用力取決於對”分子間作用力“的定義。如果“分子間作用力”繼續被狹義指代“分子的永久偶極和瞬間偶極引起的弱靜電相互作用”。這樣氫鍵與分子間作用力性質也不完全相同,量子力學計算方法也不完全同……,更像並列關係,氫鍵就不屬於分子間作用力。而我們目前國內普通化學教材、百科大辭典等,就是這個定義,就是狹義指代范德華力。
如果”分子作用力“定義指代一切分子的相互作用(這個定義也包括了長程和短程的相互作用),那麼氫鍵也屬於分子間作用力,不僅氫鍵屬於,離子鍵力也屬於分子間作用力。《高分子界面科學》一書,張開教授認為引力常數項可將各種極化能(偶極、誘導和氫鍵能)歸併為一項來計算從這一角度出發,范德華力偶極矩相互作用係數可擴大範圍寫成靜電相互作用係數。這樣得到了關於靜電力的廣義范德華力。這樣分子間相互作用的分類一些文獻也有報道。《流體的熱物理化學性質—對應態原理及其應用》作者項紅衛教授認為分子作用勢能的三個類型統稱范德華力,包括定向力、誘導力和色散力,定向力來源於偶極矩產生的引力包括電荷、偶極和四級矩其相互作用由玻爾茲曼權重因子按1/kT冪指數展開可得到平均勢能函數。電荷、偶極和四級矩這些類型的相互作用十分相似均可認為服從Berthelot規律。由於色散力不會產生誘導作用,實際誘導相互作用按靜電力比例修正。
張季爽和申成對於HF量子計算表明,氫鍵的形成至少四種不同類型的相互作用:1.HF偶極矩的取向力;2.HF分子最高被佔用軌道與另一分子最低空餘軌道發生軌道重疊和電荷轉移作用,即類共價鍵。3,分子間電子云的排斥作用。4.分子間的誘導偶極作用,非常微弱。氫鍵的本質也是靜電相互作用,主要是偶極作用能和靜電作用能近似可以用廣義范德華力計算式計算,氫鍵作用是氫鍵力的幾何平均值服從Berthelot規律。
由此來看,氫鍵包含”分子間作用力“集合所構成的”元素“,兩個集合有交集。但是氫鍵還具有它所不具有的特徵軌道重疊與電荷轉移。
超強氫鍵具有類似共價鍵本質,在學術上有爭議,必須和分子間作用力加以區分。
很多弱相互作用,既存在於分子內又存在於分子間(從量子化學角度來看);而且可以向化學鍵轉化。所以筆者建議用更嚴格的辭彙統稱為“次級鍵”,而不再用分子間作用力來涵蓋全部的弱相互作用。
另外,由於存在爭議,其從屬概念的辨析取決於對”分子間作用“的基本定義。而加州大學伯克利分校的John M. Prausnitz指出:”我們對分子間作用力認識遠遠不夠,目前只局限於簡單理想情況“。筆者認為因此在基礎教育,比如中學教育,不必嚴格區分從屬關係,重點在於了解性質。無論說氫鍵屬於或不屬於分子間作用力都不算錯誤。要將分子間作用力和氫鍵概念的辨析從屬關係的考試題可以從考試中剔除(考誰屬於誰是沒有意義的),可以休矣!學生更重要的在於了解,氫鍵的特性以及幾何平均關係、不嚴格飽和性和方向性、熔沸點、溶解度影響、穩定性以及π氫鍵等等。因為我們對分子間作用力認識遠遠不夠……我們可以參見2011IUPAC對氫鍵的重新定義來看。
氫鍵是比我們以為的要更加模糊的實體。IUPAC的成員之一、印度科技大學的高塔姆·丹瑟拉朱表示:“它同明顯的邊界之間沒有相互關係。”
丹瑟拉朱表示,這不僅僅與語義學有關。一個新的定義將對抗化學家們普遍接受的一種有關氫鍵什麼時候、在什麼地方出現的誤解,並且鼓勵他們思考氫鍵在新的環境——比如考慮到形成有機分子並採用一種以前認為不可能的反應方式下的影響。探索這條道路可能有助於我們研發出更加便宜的、更加環保的有機物,遠離目前對有毒的、昂貴且包含了珍貴金屬元素的催化劑的依賴。
上文討論的氫鍵給出的定義均是傳統鮑林定義,而在2011年IUPAC給出了重新定義。
氫鍵就是鍵合於一個分子或分子碎片X—H上的氫原子與另外一個原子或原子團之間形成的吸引力,有分子間氫鍵和分子內氫鍵之分,其X的電負性比氫原子強。可表示為X—H……Y—Z 。“……”是氫鍵。 X—H是氫鍵供體,Y是氫鍵受體,Y可以是分子、離子以及分子片段。受體Y必須是富電子的,可以是含孤對電子的Y原子也可以是含π鍵的Y分子,X,Y相同原子時形成對稱氫鍵。
IUPAC給出的氫鍵六準則:
● ● 氫鍵形成主要源於靜電作用力。由於供體和受體之間電荷遷移產生靜電相互作用,導致H原子核Y原子之間形成部分共價鍵,共價鍵的形成由離散作用所引起。
● ● X與氫原子間形成正常的共價鍵X—H是極性鍵。H……Y的強度隨X電負性增加而增加。
● ● X—H……Y之間的二面角是直線或接近180度。氫鍵越強H……Y距離越短。
● ● 氫鍵形成使得X—H距離增長,結構變化反映在X—H紅外伸縮頻率紅移。且增加X—H伸縮振動的紅外吸收有效截面。X—H……Y中X—H鍵長增加得越多,H……Y氫鍵就越牢固,一些新的振動模式也相繼形成。
● ● NMR譜中X—H……Y—Z氫鍵的形成導致X和Y原子之間氫鍵自旋-自旋耦合以及核Overhauser效應增強氫鍵還產生特徵NMR信號,X—H上H原子質子去屏蔽。
● ● 氫鍵的吉布斯自由能大於體系熱能。
規則1指出,氫鍵源於靜電作用,色散相互作用不再認為是氫鍵,而規則6是為弱氫鍵提供能量判斷的底線。IUPAC規則指出,氫鍵形成可以看做質子遷移反應杯部分激活的先兆。氫鍵網狀結構表現出來的協同現象,導致氫鍵性質不具備按隊相加性。氫鍵在成鍵方向的最優選擇影響晶體的結構堆積模式。氫鍵電荷遷移估算表明氫鍵相互作用能與供體和受體間電荷遷移程度密切相關。通過對氫鍵體系電荷密度拓撲分析,X,Y原子間會顯示一條連接X、Y以及鍵臨界點的鍵徑。
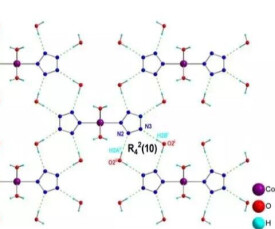
中科院國家納米科學中心2013年11月22日宣布,該中心科研人員在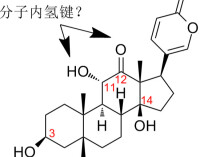 國際上首次“拍”到氫鍵的“照片”,實現了氫鍵的實空間成像,為“氫鍵的本質”這一化學界爭論了80多年的問題提供了直觀證據。這不僅將人類對微觀世界的認識向前推進了一大步,也為在分子、原子尺度上的研究提供了更精確的方法。
國際上首次“拍”到氫鍵的“照片”,實現了氫鍵的實空間成像,為“氫鍵的本質”這一化學界爭論了80多年的問題提供了直觀證據。這不僅將人類對微觀世界的認識向前推進了一大步,也為在分子、原子尺度上的研究提供了更精確的方法。

氫鍵
這一成果發表在日前出版的《科學》雜誌上,被評價為“一項開拓性的發現,真正令人驚嘆的實驗測量”“是一項傑出而令人激動的工作,具有深遠的意義和價值”。
這項研究是由國家納米科學中心研究員裘曉輝和副研究員程志海領導的實驗團隊,以及中國人民大學物理系副教授季威領導的理論計算小組合作完成的。裘曉輝帶領的研究團隊對一種專門研究分子、原子內部結構的顯微鏡——非接觸原子力顯微鏡進行了核心部件的創新,極大提高了這種顯微鏡的精度,終於首次直接觀察到氫鍵,為爭論提供了直觀證據。另外據稱,氫鍵有望解決姆潘巴現象。
氫鍵的高清晰照片能幫助科學家理解其本質,進而為控制氫鍵、利用氫鍵奠定基礎。在此基礎上,我們未來有可能人工影響或控制水、DNA和蛋白質的結構,生命體和我們生活的環境也有可能因此而改變。如支撐DNA雙螺旋結構的就是氫鍵,氫鍵還能解開和複製,在生命遺傳中起到非常重要的作用。
2013年這一年中,從分子結構到遙遠的星球,科學界繼續帶給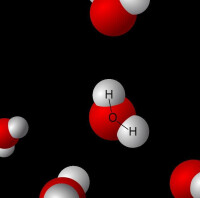 人們眾多驚奇,以下便是《自然》雜誌評選的年度圖片。運用原子力顯微鏡,來自中國科學院的紹興籍科學家裘曉輝和他的隊友們首次成功捕捉到了氫鍵的圖像。圖中加了黃色標示的即為氫鍵。
人們眾多驚奇,以下便是《自然》雜誌評選的年度圖片。運用原子力顯微鏡,來自中國科學院的紹興籍科學家裘曉輝和他的隊友們首次成功捕捉到了氫鍵的圖像。圖中加了黃色標示的即為氫鍵。

氫鍵