共找到2條詞條名為氟化氫的結果 展開
- 氟元素與氫元素組成的二元化合物
- 氟化氫氣體的水溶液
氟化氫
氟元素與氫元素組成的二元化合物
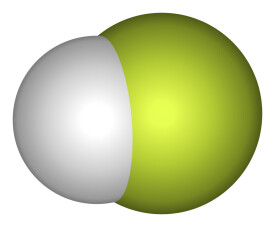
氟化氫(化學式:HF)是由氟元素與氫元素組成的二元化合物。英文名:hydrogen fluoride,它是無色有刺激性氣味的氣體。氟化氫是一種一元弱酸。氟化氫及其水溶液均有毒性,容易使骨骼、牙齒畸形,氫氟酸可以透過皮膚被黏膜、呼吸道及腸胃道吸收,中毒后應立即應急處理,並送至就醫。與五氟化銻混合後生成氟銻酸(HSbF6)。
氣化熱:30.31kJ·mol;
| 熔點(℃): | -83.7 | 相對密度(水=1): | 1.15 |
| 沸點(℃): | 19.5 | 相對蒸氣密度(空氣=1): | 1.27 |
| 分子式: | HF | 分子量: | 20.01 |
| 主要成分: | |||
| 飽和蒸氣壓(kPa): | 53.32(2.5℃) | 燃燒熱(kJ/mol): | 無意義 |
| 臨界溫度(℃): | 188 | 臨界壓力(MPa): | 6.48 |
△fH:-271kJ/mol;
△fG:-273kJ/mol;
鍵能:568.6kJ/mol;
水合熱:-48.14kJ/mol;
pKa:3.2。
氟化氫在化學熱力學上是穩定的,即使在1273K下也幾乎不分解。
氣態HF是HF單體與環狀六聚體(HF)6的混合物質,固態HF中存在鋸齒狀的鏈狀HF多聚體。
液態的HF是一種酸性非常強的溶劑,能夠質子化硫酸與硝酸。但HF在水溶液中是一種弱酸,當HF的濃度超過5mol/L時,其酸性會增強,但仍然不能完全電離。
1.具有很強的腐蝕性,能侵蝕玻璃和硅酸鹽而生成氣態的四氟化硅,但不腐蝕聚乙烯、鉛和白金;
2.極易揮發,置於空氣中即冒白霧,溶於水時激烈放熱而成氫氟酸;
3.與金屬鹽、氧化物、氫氧化物作用生成氟化物;
4.能與普通金屬發生反應,放出氫氣而與空氣形成爆炸性混合物;
5.氟化氫對熱穩定,加熱到1000℃僅稍有分解;
6.與硅和硅化合物反應生成氣態的四氟化硅: SiO2(s)+ 4 HF(aq)→ SiF4(g) + 2 H2O(l)生成的SiF4可以繼續和過量的HF作用,生成氟硅酸:SiF4(g)+2HF(aq)=H2[SiF6](aq),氟硅酸是一種二元強酸;
7.氫氟酸在水溶液中有兩個平衡:1.HF=H+ F- k1=7.2*10-4,2.HF+F-=HF2- k2=5.2此時隨著濃度增大(大於5mol),HF已經是相當強的強酸了。
8、氫氟酸能形成酸式鹽,氫氟酸本是一元酸,但能製得一系列的酸式鹽如NaHF2、KHF2、NH4HF2等,這種性質是其他三種氫鹵酸所不具有的。
氟化工是我國目前新興的、重點發展的精細化工 行業之一。氟化工產品主要包括氟製冷劑、高效滅火 劑、含氟塑料、含氟塗料、含氟表面活性劑的原料,還用於生產各種無機鹽如氟化銨、氟化氫銨等。據資 料報道,2005 年全世界氟化氫產量達 500 萬噸,中國 的產量約佔世界總產量的 10 %。隨著國民經濟的發 展,國內對氟化工產品的需求也日益增加,國內外市 場的擴大,進一步加快了我國氟化工行業的發展。氟化工產品中涉及的危險化學品種類多、易揮 發、毒性高、腐蝕性強,還有火災、爆炸的危險。許 多氟化物在生產過程中,殘存的氟氣水解或作為生產 反應的副產物不可避免的會含有少量的氟化氫,對於 某些高純的氟化物,氟化氫的含量會直接影響產品的質量.
氟化物的測定方法主要分為兩類,即直接法和間 接法。直接法是樣品不經任何預處理直接用儀器測 定,如質子誘導γ射線發射光譜法(PIGE)直接測定 樣品中的氟,該方法是建立在 N9 質子激活法(或中 子激活法)基礎上的目前最為先進的分析方法,不僅 消除了樣品基體和化學形態對測定造成的影響,而且 提高了方法的靈敏度,唯一的缺點是儀器所必須的質 子或中子源很難獲得,因此很大程度上限制了該方法 的普及。間接法是指經過適當的預處理將樣品進行定 量轉化後進行分析,較為常用的分析方法有以下幾種:化學滴定法、比色法、氟離子選擇電極法和離子色譜 法。
化學滴定法對氟化氫的分析而言,是比較準確、簡便快速的分析方法。主要是利用氟化氫的酸性特 征,在吸收了氟化氫的水溶液中加入指示劑,然後用 鹼性標準溶液進行標定,直至指示劑變色顯示達到滴 定終點,所用鹼液的體積,計算出氟化氫的含量,從 而進一步計算出氟化氫在待測樣品中的含量。
此方法 對於微量氟化氫的分析要使用微量滴定管,而且要對 滴定所用的標準溶液進行準確的標定,但由於是分析 人員手動操作,難免引入人為誤差,加之有些指示劑 的變色有一定的範圍,所以化學滴定法還需要不斷完 善。近年來,很多人在改善滴定法精度方面做了進一 步的探索,如在氯乙酸緩衝體系中,以茜素磺酸鈉一次甲基為指示劑,用硝酸釷標準溶液滴定 氟,可以避免 Fe3+、Al3+ 、Si4+對滴定的干擾。還有 人在pH=7 的條件下,用強酸性陽離子交換樹脂交換分離 Fe3+、Al3+ 、Mg2+、Mn2+等干擾離子后,使溶液 中的氟離子在醋酸鉛中形成沉澱,過濾后,濾液在 pH=5.5 以下,以二甲酚橙為指示劑,用EDTA 滴定 剩餘離子,以其消耗量計算出氟離子的含量。總之,滴定分析法是氟離子分析的一種傳統方法,在氟離子 較高含量的分析中,應用較為廣泛,技術較為成熟,但在微量分析中,分析結果還不盡人意。
比色法也稱為氟試劑分光光度法,其原理是氟試 劑(茜素絡合酮,即 3-甲基胺-茜素-二乙酸,簡 稱 ALC,C14H7O4CH2N(CH2COOH)2)在 pH4.3 的溶 液中,與硝酸鑭反應生成紅色的鑭—茜素絡合酮螯合 物,此螯合物在一定酸度、有乙酸根離子存在下、能 與氟離子形成藍色的三乙鑭—氟-茜素絡合酮螯合 物,從而根據顏色深淺,用分光光度計法測定。
此方法中氟與鑭茜素反應,在室溫下生成速度緩慢,要 1 小時左右才能顯色穩定,所以不利於在短時間內對 多個批樣進行測定。雖然可以通過分批加熱促進反應 加速,但分析精度只有±3 %~10 %,有待於進一步 改進革新。氟試劑具有酸鹼指示劑的性質,在 pH4.3 以下由黃色變為紅色。氟試劑與鑭在 pH4.3 時生成紅 色絡合物,但該化合物的穩定性較差,當有氟離子存 在時,在一定的 pH 值條件下(4.3~4.8)即可形成穩 定的藍色三元絡合物,其藍色程度與氟離子含量呈直 線關係。氟試劑比色法具有較高的靈敏度和準確度,但測定範圍較窄(5~70)μg/10mL。此方法的靈敏 度與氟試劑和鑭的比例有很大關係。
二者的摩爾比為 1:1 時靈敏度最高,若氟試劑比鑭的比值小很多,有 氟化鑭沉澱產生,使比色液出現粉紅色,若氟試劑過 多,則會使靈敏度下降。氟試劑測定氟離子,可穩定 24 h。但生成的藍色絡合物的吸光值受顯色的 pH 值、丙酮及緩衝溶液用量的影響較大。對於酸、鹼性較強 的吸收液要事先中和,再進行比色測定。使用混合顯 色劑,操作簡便、快速,避免各種試劑分別加入造成 的誤差。但混合顯色劑不能久置,否則反應靈敏度下 降,應該在使用前配置。為了改善分析的靈敏 度,消除常規元素對分析過程的干擾,許多人對比色 法做出了改進。如鄧恢祥等改用合併試劑,嚴格控制酸的濃度,加入乙醯丙酮掩蔽劑,消除鋁、鐵、鋅 的干擾。結果表明該法具有靈敏度高,精密度及準確 度可靠,樣品用量少,抗干擾能力強的優點。
氟離子選擇電極法的應用原理是氟電極中的氟 化鑭單晶膜對待測氟離子產生選擇性的對數相應,電 位差隨溶液中氟離子的活度改變而變化,電位變化符 合能斯特公式,根據電位差求出氟離子的濃度。
由於 電極法是利用電極對氟離子的專屬響應,因此無需預 先將氟從本底干擾中分離出來,但要進行直接的電位 測量,則需加入一定的緩衝劑和絡合劑,以控制溶液 的 pH 值和總離子強度,以減少氫氧根和一些高價陽 離子(Fe3+、Al3+ 等)的干擾。由於氟離子選擇電 極法操作簡便、快速,且儀器的價格較低而得到廣泛 的應用。氟離子選擇電極具有良好的性能,很好的選 擇性,電極本身的干擾離子只有OH- ,選擇係數大約 為 0.1,此干擾可用控制 pH 方法消除,對於其它干擾 離子則使用一種總離子強度調節緩衝劑進行消除。但由於電極性能等原因,一般稍經使用過的電極,在 低於 2.63×10-5 mol/L 的濃度範圍內,呈非直線響應 關係,難以得到準確可靠的測定結果。王銀起等使用加入水溶性低介電常數溶劑丙酮(介電常數 20.7)和乙醇(介電常數 24.30)的方法測定樣品,改 善電極的線性範圍和檢出限,提高低濃度測定時的精 密度。
是一種分析無機和有機離子的液相 色譜技術,於 70 年代中期問世,很快發展為分析水 溶液中陰離子的較好方法。它的測定原理是水樣中 的待測陰離子隨碳酸鹽-重碳酸鹽淋洗液進入離子 交換柱系統(由分離柱和保護柱組成),根據分離柱 對各陰離子的不同親和度進行分離,由電導檢測器測 量各陰離子組分的電導率,以保留時間定性,峰高或 峰面積進行定量分析。
它將高效柱色譜分離和靈敏的 自動檢測手段結合,因而最適合於多組分與多元素的 同時分析,其靈敏度高、選擇性好、樣品用量少、易 於實現自動化。與分光光度法相比,可將氟化物 絡合物與試劑分離開,大大提高了測定的靈敏度與選擇性。陳寧等針對離子色譜法與離子選擇電極法測定 水中的氟化物存在一定偏差的現象,較詳細的研究了 影響測定結果的干擾因素,確定碳酸根、碳酸氫根均 能產生正干擾,其干擾程度與干擾物質的含量成正 比,為消除基體的干擾,其干擾程度與干擾物質的含 量成正比,為消除基體的干擾,可採用標準加入法。由於離子色譜法可以通過自動進樣器和分析軟體控 制,自動進樣,自動進行定性和定量分析,可以大大 降低操作人員的勞動量,但是離子色譜法所需儀器設 備較貴,使其應用受到一定限制。
隨著分析儀器的不斷改進與發展,氟化氫的分析 技術也有了長足的發展與進步,其分析精度和準確度 都有了大幅度的提高。近年來發展起來的氟化氫分析 方法主要有熒光分析法、發射光譜法、流動注射系統 法和傅立葉紅外光譜法等。
熒光分析法的檢測下限較低,靈敏度高。氟離子 在弱酸介質中可以在 495nm 波長處激發,525nm 處 有較強的熒光產生,當有三價鋁離子存在時,熒光強 度減弱,加入氟離子后,熒光重新增強。研究表明,鋁離子絡合物的熒光強度,會被氟離子熄滅,以 365nm 激發,於 575nm 測定熒光強度,共存離子如:鉀、鈣、鈉、鎂、碳酸根以及氯離子的含量在淡水中 濃度存在時,不影響氟離子的測定。
目前氟離子的熒 光分析方法研究還主要在二元或三元熒光反應體系 中加入增效試劑,改變分子的吸光和發光光譜,增大 熒光量子產率,對提高靈敏度和選擇性,改善實驗條 件,具有重大意義。
以電弧為光源的發射光譜法是一種重要的原子 發射光譜分析方法,對像氟離子之類的鹵素,其光譜 激發能較高,用弧光雖不能激發,但可以在弧光中形 成分子發射體,因此可利用分子光譜帶來測定。近年 來發展的以電感耦合等離子體為光源的原子發射光 譜成為現代分析領域最活躍和發展最快的分析方法。
但由於它對氟離子的測定要先將氟離子轉化為有機 絡合物,故必須克服有機相直接進樣,導致其應用具 有樣品轉化困難的缺點,另外其分析靈敏度也有待進 一步完善。
近年來,氟離子選擇電極發展出一種新技術—— FIA(流動注射)系統測氟。自 1975 年 Rrzicka 與 Hansen 奠定了流動注射分析的理論與實驗基礎后,流 動注射分析已成為一種新型的處理溶液的手段。其優 點是:(1)微量樣品自動進樣;(2)可用於高鹽分析 和高粘度樣液分析;(3)可以實現在線預分離、富集 或稀釋;(4)高採樣頻率((100~200)次/h);(5)梯度稀釋技術可以實現一次注射,繪製標準曲線。其 分析速度快,測定精密度高[10]。由於 FIA 是一種很有 前途的快速分析方法,它可以與多種方法結合使用,其在氟離子的測定應用方面還有待於進一步的研究 與探索。
紅外光譜法主要研究在振動中伴隨有偶極矩變 化的化合物,因此,除了單原子和同核分子如 Ne、 He、O2 和 H2等之外,幾乎所有的化合物在紅外光區 均有吸收。
通常,紅外吸收帶的波長位置與吸收譜帶 的強度,反映了分子結構上的特點,可以用來鑒定未 知物的結構組成或確定其化學基團;而吸收譜帶的吸 收強度與分子組成或其化學基團的含量有關,這是其 可以用來定量分析的基礎。對氟化氫的定量分析就是 利用不同濃度的氟化氫其特徵吸收峰的強度不同,首 先利用一系列標準氟化氫氣體建立工作曲線,然後利 用傅立葉紅外光譜測定待測氟化氫的吸光度值,進一 步利用工作曲線得到待測物質中氟化氫的含量。
據文獻記載,以極譜波波譜法在 pH(4.8~5.0)六甲基四胺緩衝劑中,La-茜素(AL)-氟體系中 的三元絡合吸附波,與 La-AL 二元絡合物吸附波相 比,波形良好,單掃描波高,與氟離子在(1×10-7~6 ×10-6)mol/L 成正比。以電勢滴定測定氟,在 70 %甲醇溶液與二氧六環溶液中以 pH5.6 以上,用 La3+ 標準溶液滴定,但其滴定過程容易受到金屬離子的干擾。此外還有用庫侖法產生 La3+滴定 F- ,X 射線熒 光法測定氟離子以及微量氟化氫分析儀的研製 等相關報道。
2、在電子工業中用作強酸性腐蝕劑,可與硝酸、乙酸、氨水、雙氧水配合使用。
3、用作分析試劑,也用於高純氟化物的製備。是氟鹽、氟致冷劑、氟塑料、氟橡膠、氟醫藥及農藥等所必需的氟來源
4、是生產冷凍劑“氟里昂”、含氟樹脂、有機氟化物和氟的原料。在化工生產中可用作烷基化、聚合、縮合、異構化等有機合成的催化劑。還用於開採某些礦床時腐蝕地層,以及稀土元素、放射性元素的提取。在原子能工業和核武器生產中是製造六氟化鈾的原料,也是生產火箭燃料和添加劑的原料,還可用於腐蝕玻璃和浸漬木材等。
5、用於有機或無機氟化物的製造,如氟碳化合物、氟化鈉、氟化鋁、六氟化鈾和冰晶石等。也用於不鏽鋼、非鐵金屬酸洗,玻璃儀錶刻度、玻璃器皿和鏡子刻花、刻字,以及玻璃器皿拋光、磨砂燈泡和一般燈泡處理、金屬石墨乳除硅提純、金屬鑄件除砂、石墨灰分的去除、半導體(鍺、硅)的製造。也用作染料合成。及其他有機合成的催化劑。還用於電鍍、試劑、發酵、陶瓷處理以及含氟樹脂和阻燃劑的製造等。
6、用於刻蝕玻璃,酸洗金屬,制無機類氟鹽產品及化學試劑。
7、用於原子能工業、制元素氟、氟化物,也可作催化劑、氟化劑等 用於有機或無機氟化物的製造,也用於不鏽鋼、非鐵金屬酸洗、玻璃器皿磨砂和酸洗、磨砂燈泡的處理等。
皮膚接觸:立即脫去污染的衣著,用大量流動清水沖洗至少15分鐘。就醫。
眼睛接觸:立即提起眼瞼,用大量流動清水或生理鹽水徹底沖洗至少15分鐘。就醫。
危險特性:氟化氫為反應性極強的物質,能與各種物質發生反應。腐蝕性極強。
滅火方法:消防人員必須穿特殊防護服,在掩蔽處操作。噴水保持火場容器冷卻,直至滅火結束。
應急處理:迅速撤離泄漏污染區人員至安全區,並立即隔離150m,嚴格限制出入。應急處理人員必須佩戴防護用具。儘可能切斷泄漏源。防止流入下水道、排洪溝等限制性空間。若是氣體,合理通風,加速擴散。噴氨水或其它稀鹼液中和。構築圍堤或挖坑收容產生的大量廢水。也可以將殘餘氣或漏出氣用排風機送至水洗塔或與塔相連的通風櫥內。漏氣容器要妥善處理,修復、檢驗后再用。若是液體,用砂土或其它不燃材料吸附或吸收。也可以用大量水沖洗,洗水稀釋後放入廢水系統。若大量泄漏,構築圍堤或挖坑收容。用泵轉移至槽車或專用收集器內,立即切斷泄漏源,將盛裝容器移出至安全區,對泄漏現場進行標識,防止污染擴大和二次污染,應急處理用具、現場、廢水等都應繼續進行無害化處理,達到環保要求。
健康危害:對呼吸道粘膜及皮膚有強烈的刺激和腐蝕作用。
急性中毒:吸入較高濃度氟化氫,可引起眼及呼吸道粘膜刺激癥狀,嚴重者可發生支氣管炎、肺炎或肺水腫,甚至發生反射性窒息。眼接觸局部劇烈疼痛,重者角膜損傷,甚至發生穿孔。氫氟酸皮膚灼傷初期皮膚潮紅、乾燥。創面蒼白,壞死,繼而呈紫黑色或灰黑色。深部灼傷或處理不當時,可形成難以癒合的深潰瘍,損及骨膜和骨質。本品灼傷疼痛劇烈。慢性影響:眼和上呼吸道刺激癥狀,或有鼻衄,嗅覺減退。可有牙齒酸蝕症。骨骼X線異常與工業性氟病少見。
燃爆危險:該品不燃,高毒,具強腐蝕性、強刺激性,可致人體灼傷。
呼吸系統防護:空氣中濃度超標時,必須佩戴防毒面具或供氣式頭盔。緊急事態搶救或逃生時,必須佩戴防護用品。
眼睛防護:戴化學安全防護眼鏡。
防護服:穿工作服(防腐材料製作)。
手防護:戴橡皮手套。
其它:工作后,淋浴更衣。單獨存放被毒物污染的衣服,洗后再用。保持良好的衛生習慣
操作注意事項:密閉操作,注意通風。操作儘可能機械化、自動化。操作人員必須經過專門培訓,嚴格遵守操作規程。建議操作人員佩戴自吸過濾式防毒面具(全面罩),穿橡膠耐酸鹼服,戴橡膠耐酸鹼手套。避免產生煙霧。防止氣體或蒸氣泄漏到工作場所空氣中。遠離易燃、可燃物。搬運時輕裝輕卸,防止鋼瓶及附件破損。配備泄漏應急處理設備。倒空的容器可能殘留有害物。
儲存注意事項:儲存於陰涼、通風的庫房。遠離火種、熱源。庫溫不宜超過30℃。應與易(可)燃物、食用化學品分開存放,切忌混儲。儲區應備有泄漏應急處理設備。應嚴格執行極毒物品“五雙”管理制度。
無水氟化氫的生產工藝主要有兩種:硫酸法(螢石法)和回收法。目前幾乎所有的工業化生產裝置均用螢石法,而回收法一直處於開發起步階段,有少數生產廠家已投入工業化裝置。
螢石-硫酸法
此法所需的主要原料為螢石和硫酸,兩種原料在生產過程中均被消耗。生產工藝為:將乾燥后的螢石粉和硫酸按配比1:(1.2~1.3)混合,送入迴轉式反應爐內進行反應,爐內氣相溫度控制在280±10℃。反應后的氣體進入粗餾塔,除去大部分硫酸、水分和螢石粉,塔釜溫度控制在100~110℃,塔頂溫度為35~40℃。由於螢石中含有SiO2、碳酸鈣、氧化鋁及鐵礦石等雜質,還伴隨有相應的副反應及其副產物,因此粗氟化氫氣體需再經脫氣塔冷凝為液態,塔釜溫度控制在20~23℃,塔頂溫度為一8±1℃,然後進入精餾塔精餾,塔釜溫度控制在30~40℃,塔頂溫度為19.6±0.5℃。精餾后將雜質除去,得到高純無水氟化氫。其主反應式如下:
CaF2+H2SO4→2HF+CaSO4
回收法
回收法是指對磷化工業副產物氟化硅直接回收利用,其中包括氟硅酸銨法、石灰法、Buss法、火焰水解法和鹼金屬鹽轉化回收法等。
(1)氟硅酸銨法
先將四氟化硅氣體與循環的氟化銨溶液反應,生成氟硅酸銨:
SiF4+2NH4F→(NH4)2 SiF6
再次用氨中和,生成二氧化硅沉澱和氟化銨:
(NH4)2 SIF6 +(n+2)H2O+4NH3→SiO2.nH2O↓+6NH4F
過濾除去沉澱的二氧化硅,得到氟化銨溶液。除留足循環用量外,多餘部分在140~150℃濃縮,然後在170 ~ 180℃用硫酸分解得無水氟化氫和硫酸氫銨。
(2)石灰法
將磷酸副產的20%氟硅酸溶液與氫氧化鈣於70~75℃進行中和反應,生成氟化鈣:
3Ca(OH)2,+H2SiF6→3CaF2+SiO2+H2O
產物經過濾、造粒後送入轉窯,通入蒸汽加熱至1050℃,發生下述反應生成氟化氫:
CaF2+H2O+SiO2→CaSiO3+2HF
氟化鈣也可用碳酸鈣懸浮物與氟硅酸直接反應生成。
(3)BUSS法(布希法)
將磷肥廠洗滌廢氣得到的氟硅酸濃縮並氣化為HF-SiF4-H2O混合物,然後用多元醇有機溶劑選擇吸收氟化氫,經真空蒸發從溶劑中解吸氟化氫后,液化、再經兩級精餾提純得無水氟化氫。
(4)火焰水解法
四氟化硅用氫或烴火焰在1100℃以上水解可得二氧化硅和氟化氫。氣體中約有70%~85%(以元素氟計)轉化為氟化氫,用稀的氫氟酸吸收,經濃硫酸脫水可得無水氟化氫。
(5)氟硅酸與硫酸反應的回收法
該回收法是在BUSS法基礎上創新改進得到的新工藝技術,即利用磷礦石分解產生的磷酸副產氟硅酸為原料與濃硫酸反應製取無水氟化氫工藝技術。具體生產方法為:
H2SiF6・SiF4+H2SO4(濃)→SiF4+2HF+H2SO4(稀)
SiF4氣體返回到接觸器被氟硅酸吸收,反應按反應下式進行:
5SiF4+2H2O→2H2SiF6・SiF4+SiO2(水合物)
氟硅酸吸收SiF4后,經式反應析出SiO2,濃度增大,與硫酸進行反應生成HF。
上述生產方法工藝流程主要由濃縮、過濾、反應、蒸餾、預凈化、精餾、汽提、吸收、尾氣洗滌等單元組成。
①濃縮:稀氟硅酸在濃縮單元生成濃氟硅酸和二氧化硅沉澱。
②過濾:濃縮反應液經過濾分離得到濃氟硅酸,濾餅洗滌產生廢水集中收集後部分作為洗滌水回用,部分送磷酸系統使用,不外排。二氧化硅渣集中收集後進一步綜合利用。
③反應:過濾的濃縮氟硅酸進入反應單元,在濃硫酸的作用下,氟硅酸分解成四氟化硅和氟化氫。
④蒸餾:來自反應的含有氟化氫的混酸反應液進蒸餾系統蒸餾得到粗HF氣體。
⑤預凈化和精餾:蒸餾的粗HF氣體在預凈化塔降溫併除去大部分高沸點雜質,液體雜質返回蒸餾系統,粗HF經冷凝后泵送到加壓精餾系統,輕組分雜質SO2、SiF4從塔頂脫除,並送到吸收系統;塔底出料為無水氟化氫產品。
⑥汽提:蒸餾硫酸含有少量HF通過汽提塔脫出;塔底得到70%~75%的稀硫酸全部返回到磷酸裝置繼續使用,汽提出來的氣體進吸收系統。
⑦吸收和尾氣洗滌:用濃硫酸吸收反應、汽提、精餾系統尾氣中所含HF和水分,將分離出的四氟化硅送至濃縮系統進行反應;其餘尾氣送至串級洗滌系統洗滌,洗滌后的達標尾氣高空排大氣;洗滌廢水再次用於二氧化硅濾餅洗滌。
工業級的無水氟化氫氣體一般以液化氣形式銷售,其中含有水、硅、砷及硫的化合物等雜質。工業上要製造高純的無水氟化氫,可通過蒸餾、電解和生成配位化合物等方法進行提純。
氟化氫與水結合很強,並能生成恆沸混合物,脫去其中的水分困難,工業上採用以下幾種方法脫水:利用電解方法除去氟化氫粗品中大量水分和砷的化合物,再用有機溶劑(如烷基胺、丁烷、環己醇、異己酮和異戊酮等)萃取、蒸餾分離其中水分得到無水氟化氫純品。