無水碳酸鈉
無水碳酸鈉
白色粉末,無氣味。有鹼味。有吸濕性。露置空氣中逐漸吸收1mol/L水分(約15%)。400℃時開始失去二氧化碳。遇酸分解並泡騰。溶於水(室溫時3.5份,35℃時2.2份)和甘油,不溶於醇。水溶液呈強鹼性,pH11.6。
中文名稱:無水碳酸鈉
英文別名:Carbonic acid, disodium salt,Soda
CAS號:497-19-8
特性:無結晶水,易受潮
目數:18-20最佳(特別要求的可達80-100,易潮變)
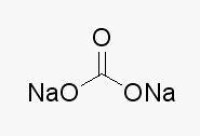
無水碳酸鈉
在人工合成純鹼之前,古代就發現某些海藻晾曬后,燒成的灰燼中含有鹼類,用熱水浸取、濾清后可得褐色鹼液用於洗滌。大量的天然鹼來自礦物,以地下埋藏或鹼水湖為主。以沉積層存在的天然鹼礦品位最高,分佈甚廣。最早發明人工合成純鹼方法是18世紀末,法國路布蘭用芒硝加石灰石和煤在高溫下還原並進行碳酸化,得到以含Na2CO3為主的粗製品——黑灰,經過浸取、蒸發、精製、再結晶、烘乾,獲得純度約為97%的重質純鹼。1861年,比利時歐內斯特·索爾維獨自發明了純鹼並獲得過專利。由於技術秘密保護一直未能大範圍應用,20世紀20年代才從美國突破,尤其是中國著名的化工專家侯德榜於1932年出版了《純鹼製造》一書,將保密70年,索爾維法公佈於世。侯德榜還於1939-1942創建了侯氏制鹼法,並在四川建立了中試車間。1952年在大連化工廠設立了聯合制鹼車間。日本旭硝子公司推出的NA法,實質上是聯鹼和氨鹼的折中法。可隨意調節純鹼與氯化銨的比例。
蘇打是Soda的音譯,化學式為Na2CO3。它的名字頗多,學名叫碳酸鈉,俗名除叫蘇打外,又稱純鹼。帶有結晶水的叫水合碳酸鈉,有一水碳酸鈉(Na2CO3·H2O)、七水碳酸鈉(Na2CO3·7H2O)和十水碳酸鈉(Na2CO3·10H2O)三種。
在三種蘇打中,碳酸鈉的用途最廣。它是一種十分重要的化工產品,是玻璃、肥皂、紡織、造紙、製革等工業的重要原料。冶金工業以及凈化水也都用到它。它還可用於其他鈉化合物的製造。早在十八世紀,它就和硫酸、鹽酸、硝酸、燒鹼並列為基礎化工原料——三酸兩鹼之一。在日常生活中,蘇打也有很多用途,比如它可以直接作為洗滌劑使用,在蒸饅頭時加一些蘇打,可以中和發酵過程中產生的酸性物質。
小蘇打的化學式是NaHCO3。它的名字也有很多,學名碳酸氫鈉,又稱重碳酸鈉或酸式碳酸鈉。俗名除小蘇打外,還有焙燒蘇打、發酵蘇打和重鹼等。
小蘇打是白色晶體,溶於水,水溶液呈弱鹼性。
在熱空氣中,它能緩慢分解,放出一部分二氧化碳;加熱至270℃時全部分解放出二氧化碳:
它也能與酸(如鹽酸)作用放出二氧化碳:
小蘇打的這些性質,使它在生產和生活中有許多重要的用途。在滅火器里,它是產生二氧化碳的原料之一;在食品工業上,它是發酵粉的一種主要原料;在製造清涼飲料時,它也是常用的一種原料;在醫療上,它是治療胃酸過多的一種藥劑。
大蘇打是無色透明的晶體,易溶於水,水溶液顯弱鹼性。它在33℃以上的乾燥空氣中風化而失去結晶水。
在中性、鹼性溶液中較穩定,在酸性溶液中會迅速分解:
大蘇打具有很強的絡合能力,能跟溴化銀形成絡合物:
根據這一性質,它可以作定影劑。洗相時,過量的大蘇打跟底片上未感光部分的溴化銀反應,轉化為可溶的,把AgBr除掉,使顯影部分固定下來。
大蘇打還具有較強的還原性,能將氯氣等物質還原:
所以,它可以作為綿織物漂白后的脫氯劑。類似的道理,織物上的碘漬也可用它除去。另外,大蘇打還用於鞣製皮革、電鍍以及由礦石中提取銀等。
以上三種是較常見常用的三種“蘇打”。除此之外有時”臭蘇打“會提及進來。
臭蘇打是硫化鈉的俗名,化學式為Na2S,又稱臭鹼、黃鹼、硫化鹼,具有臭味。溶解於冷水,極易溶於熱水,微溶於醇。
硫化鈉為無機化合物,純硫化鈉為無色結晶粉末。吸潮性強,易溶於水。水溶液呈強鹼性反應。觸及皮膚和毛髮時會造成灼傷。故硫化鈉俗稱硫化鹼。
硫化鈉受撞擊或者急劇加熱可能發生爆炸,化學性質不穩定,遇酸會放出有毒的硫化氫氣體:
硫化鈉能用於染料工業中生產硫化染料,是硫化青和硫化藍的原料。印染工業用作溶解硫化染料的助染劑。製革工業中用於水解使生皮脫毛,造紙工業用作紙張的蒸煮劑。還可用於紡織工業中棉織物染色的媒染劑、製藥工業用於生產解熱葯。硫化鈉還可用於直接電鍍中導電層的處理,通過硫化鈉與鈀反應生成膠體硫化鈀來達到在非金屬表面形成良好導電層的目的。
實驗室方法
實驗室製取碳酸鈉:。
呂布蘭法
最早在1791年,古人就開始用食鹽、硫酸、煤、石灰石為原料生產碳酸鈉,是為呂布蘭法。
此法原料利用不充分、勞動條件惡劣、產品質量不佳,逐漸為索爾維法代替。
索氏制鹼法
1859年,比利時人索爾維,用食鹽、氨水、二氧化碳為原料,於室溫下從溶液中析出碳酸氫鈉,將它加熱,即分解為碳酸鈉,人們將此方法稱為索氏制鹼法,此法一直沿用至今:
氨氣與水和二氧化碳反應生成一分子的碳酸氫銨,這是第一步:
第二步是:碳酸氫銨與氯化鈉反應生成的碳酸氫鈉沉澱和氯化銨,碳酸氫鈉之所以沉澱是因為它的溶解度較小。經過濾得到碳酸氫鈉固體:
這兩步總的化學方程式是:
第三步:加熱分解碳酸氫鈉,生成水、二氧化碳和碳酸鈉即我們要的純鹼:
第四步:將第二步中副產的氯化銨和熟石灰混合加熱,得到的氨氣可循環利用:
侯氏制鹼法
第一步,氨氣與水和二氧化碳反應生成一分子的碳酸氫銨,第二步碳酸氫銨與氯化鈉反應生成的碳酸氫鈉沉澱和氯化銨,碳酸氫鈉之所以沉澱是因為它的溶解度較小。經過濾得到碳酸氫鈉固體。(這兩步和上面的索氏制鹼法相同)。
第三步,合成的碳酸氫鈉部分可以直接出廠銷售,其餘的碳酸氫鈉會被加熱分解,生成碳酸鈉,生成的二氧化碳可以重新回到第一步循環利用。
根據NH4Cl溶解度比NaCl大,而在低溫下卻比NaCl溶解度小的原理,在 278K~283K(5 ℃~10 ℃)時,向母液中加入食鹽細粉,而使NH4Cl單獨結晶析出供做氮肥。
索氏制鹼法和侯氏制鹼法所不同的,是索氏法在整個製取過程中NH3是循環使用的,而侯氏法在整個製取過程中,CO2被循環利用,NH4Cl直接作為純鹼的副產品——肥料。所以,索氏法的產品是碳酸鈉,副產品氯化鈣;而侯氏法的產品是碳酸鈉,副產品氯化銨。
此法優點:保留了氨鹼法的優點,消除了它的缺點,使食鹽的利用率提高到96%;NH4Cl可做氮肥;可與合成氨廠聯合,使合成氨的原料氣CO 轉化成CO2,革除了CaCO3制CO2這一工序。
技術指標
| 指標項目 | 指 標 | ||
| 1類 | 2類 | 3類 | |
| 總鹼量(%) | 99 | 98 | 96 |
| 氯化物(%) | 0.5 | 0.9 | 1.2 |
| 水不溶物(%) | 0.04 | 0.1 | 0.15 |
| 鐵(%) | 0.004 | 0.006 | 0.010 |
| 硫酸鹽(%) | 0.03 | 0.08 | - |
| 燒失量(%) | 0.8 | 1.0 | 1.3 |
露置空氣中逐漸吸收1mol/L水分(約15%)。400℃時開始失去二氧化碳。遇比碳酸強的酸酸放出二氧化碳與水。溶於水(室溫時3.5份,35℃時2.2份)和甘油,不溶於乙醇。水溶液呈鹼性,pH11.6。相對密度2.53。熔點851℃。半數致死量(30日)(小鼠,腹腔)116.6mg/kg。有刺激性。
密度:2.53
熔點:851℃
沸點:1600℃
密封乾燥保存。

無水碳酸鈉
危險標誌:Xi
危險代碼:R36
安全說明:S22-S26
本品不受管制
典型的強鹼弱酸鹽。水溶液呈鹼性。能與大部分質子酸(酸性強過碳酸的)反應,酸過量時生成二氧化碳,不過量時生成碳酸氫鈉(小蘇打)。
規格 指標名稱 | 分析純 | 化學純 |
| 含量(Na2CO3) /% | ≥99.8 | ≥99.8 |
| 澄清度試驗 | 合格 | 合格 |
| 水不溶物/% | ≤0.01 | ≤0.02 |
| 乾燥失重/% | ≤1.0 | ≤1.0 |
| 氯化物(Cl) /% | ≤0.002 | ≤0.005 |
| 硫化合物(以SO4計) /% | ≤0.005 | ≤0.01 |
| 氮化合物(以N計) /% | ≤0.001 | ≤0.002 |
| 磷酸鹽及硅酸鹽(以SiO3計) /% | ≤0.006 | ≤0.013 |
| 鎂(Mg) /% | ≤0.002 | ≤0.005 |
| 鋁(Al) /% | ≤0.003 | ≤0.01 |
| 鉀(K) /% | ≤0.005 | ≤0.02 |
| 鈣(Ca) /% | ≤0.01 | ≤0.02 |
| 鐵(Fe) /% | ≤0.000 5 | ≤0.001 |
| 重金屬(以Pb計) /% | ≤0.000 5 | ≤0.001 |
內襯塑料袋的塑料編織袋、牛皮紙袋、紙箱或紙板桶,凈重25/kg或者40/kg。
