霍夫曼規則
霍夫曼規則
20世紀60年代,美國有機化學家R.B.伍德沃德與R.霍夫曼同時提出的“分子對稱軌道守恆”這一些念歸公式化,使舉世公認。將簡單分子軌道理論引入化學反應領域,用反應分子和產物分子軌道的對稱性來論證同時發生反應分子鍵斷裂與產物分子鍵生成的協同反應的對稱性允許(發生)和對稱性禁阻(不發生)的性質,此稱伍德沃德-霍夫曼規則。
霍夫曼規則
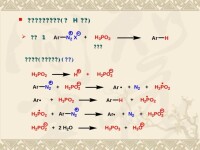
在四級銨鹽與鹼作用時所發生的脫去一分子胺的消除反應中,所生成的烯烴主要來自帶有較少取代基的烷基。上述霍夫曼規則正與扎伊采夫規則相反,但二者的應用範圍並不相同。例如,下面的四級銨鹽在消除一分子胺時,得到的烯烴是乙烯而不是丙烯:
霍夫曼規則適用於雙分子消除反應(見雙分子反應)。由於雙分子消除反應的立體化學過程是反式消除,體積大的離去基團(三級胺基)與β-H正處於相反方向。霍夫曼消除方向取決於最穩定的構象異構體,例如2-戊基三甲基銨鹽消除,得到98%的1-戊烯,只有2%的 2-戊烯。原因就是構象a中鄰交叉位只是H原子,立體效應小些;而構象b中鄰交叉位的CH3CH2基離+N(CH3)3近,立體效應大些,顯然a比b穩定。構象c的立體效應雖然最小,但是由於β-H與+N(CH3)3處於順式位置,不可能發生雙分子反式消除反應。所以構象a的消除反應主要導致生成1-戊烯。
霍夫曼規則也可應用於硫類化合物,例如:
霍夫曼規則
消除反應產物往往比較複雜,霍夫曼規則和扎伊采夫規則的相反性正反映了這種複雜性。它們各有不同的適用範圍。一般來說,扎伊采夫規則與產物的穩定性有關,而霍夫曼規則卻與反應物的穩定性有關。這兩個規則都是早期由大量實驗總結出來的經驗規則,現在根據電子理論的解釋都說明了這兩個規則在各自適用範圍內的正確性。
C.K.Ingold,Structure and Mechanism in Organic Chemistry,2nd ed.,G.Belland Sons,London,1969.
奧格斯特·威廉·馮·霍夫曼(August Wilhelm von Hofmann,1818.4.8-1892.5.2),生於吉森,1836年入吉森大學學習法律,后受到化學家J.von李比希的影響,改學化學,1841年獲博士學位,即留校任李比希的助手。1845年任倫敦皇家 化學學院首任院長和化學教授。1865年回國,任柏林大學教授。1851年當選為英國皇家學會會員。1868年創建德國化學會並任會長多年。卒於柏林。
霍夫曼最先將實驗教學介紹到英國,並培養了W.H.Jr.珀金和E.弗蘭克蘭等著名化學家。回國后又把實驗教學帶到柏林。霍夫曼的研究範圍非常廣泛。最初研究煤焦油化學,在英國期間解決了英國工業革命中面臨的煤焦油副產品處理問題,開創了煤焦油染料工業。珀金在他的指導下於1856年合成了第一個人造染料苯胺紫,他本人合成了品紅,從品紅開始,合成一系列紫色染料,稱霍夫曼紫。回國后發展了以煤焦油為原料的德國染料工業。他在有機化學方面的貢獻還有:研究苯胺的組成;由氨和鹵代烷製得胺類;發現異氰酸苯酯、二苯肼、二苯胺、異腈、甲醛;制定測定分子量用的蒸氣密度法,改進有機分析和操作法;發現四級銨鹼加熱至100℃以上分解成烯烴、三級胺和水的反應,稱霍夫曼反應(見霍夫曼規則)。

霍夫曼
霍夫曼在化學理論方面,於1849年最先提出“氨型”的概念,成為後來“類型說”的基礎。他提出胺類是由氨衍生而來的,其中氫原子為烴基取代而成。伯、仲、叔胺由此命名。他發現了季銨鹽,指出氫氧化四乙銨為強鹼性。霍夫曼發表論文300多篇,著有《有機分析手冊》和《現代化學導論》等書。
在基礎有機化學中,對於消除反應涉及到兩個基本的原則,分別稱為札依采夫規則與霍夫曼規則。札依采夫規則的中心議題為:消除掉的H主要來自於含氫較少的β-C上;而霍夫曼規則則是指消除掉的H主要來自於含H較多的β-C上。從字面上看,兩個規則的中心思想剛好完全相反,因此在適用於具體情況時要加以區分。
消除反應的取向規律與其歷程有關。典型的E1和E2反應的取向符合扎依切夫規則,如大多數的RX與ROH的消除反應。季銨鹼熱分解為E2反應,但由於氮原子上正電荷的影響,其過渡態類似e1cb歷程。當β-碳原子連有給電子基時,β-氫的酸性降低,該β-氫就不易被鹼性試劑進攻,因此,一般E1cb歷程的產物符合霍夫曼規則。當β-碳原子連有苯基、羰基等吸電子基時,季銨鹼熱分解則不服從霍夫曼規則。除與反應歷程有關外,在某些情況下還與β-H的空間位阻及E2歷程的立體化學要求有關。例如,2,2,4-三甲基-4-氯戊烷按E1歷程進行時,其優勢產物不是札依采夫規則烯烴,而是霍夫曼烯烴。這是由於β′碳上連有體積大的叔丁基,它對β′-H有較大的空問位阻,鹼就優先進攻β-H生成霍天曼烯烴。
在四級銨鹽與鹼作用時所發生的脫去一分子胺的消除反應中,所生成的烯烴主要來自帶有較少取代基的烷基。霍夫曼規則與扎伊采夫規則相反,但二者的應用範圍並不相同。
這是由於帶取代基較多的烷基,如上例中的丙基,由於甲基的給電子作用,使β′碳原子上的電子密度增加,H不容易脫去,所以不易發生消除反應。也就是說,反應以似E1cB機理進行,似E1cB機理中的過渡態具有部分碳負離子性質,其穩定性與碳負離子類似,而碳負離子的穩定性是1°>2°>3°,因此其區域選擇性不同於E1和E2反應。
在霍夫曼消除(E2消除)反應中,試劑還可以進攻α碳原子,生成取代產物。因此,E2消除和SN2反應同時發生。
許多教材中明確指出霍夫曼消除與SN2反應的競爭問題,或只是簡單的提到當四烷基氫氧化銨β位上沒有氫時,主要發生取代反應生成醇。
似乎季銨鹼的熱分解只發生霍夫曼消除反應,實際上只有很少一部分是這樣的,而大多數霍夫曼消除是與SN2反應相競爭而發生的,得到的產物有烯烴也有醇。
選擇這個反應式作為介紹霍爾曼消除反應的典型例子是比較恰當的。