碳負離子
帶負電荷具有偶數價電子的粒子
碳負離子(Carbon anion)是三個基團,有一對孤對電子的碳的活性中間體,一個單位負電荷。四面體構型。孤對電子佔一個雜化軌道。比較相應酸的酸性大小,判斷負離子穩定性大小。
由吸電子基共軛穩定化( 效應)的碳負離子,由於實際的共振結構中負電荷主要分佈在氧原子上,這類離子叫做碳負離子的性質。
一般碳負離子
碳負離子帶有負電荷,中心碳原子為三價,價電子層充滿八個電子,具有一對未共用電子。中心碳原子的可能構型有兩種:一種為雜化的平面構型,另一種雜化的稜錐構型。
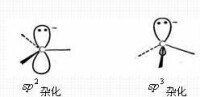
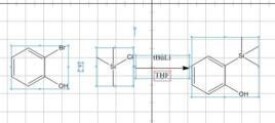
圖1
特殊的碳負離子
雖然環丙基正離子由於環張力不利於平面構型而很不穩定,但環丙基負離子確是存在的,因為稜錐構型對碳負離子是相對有利的。在橋環化合物中,橋頭碳正離子是很不穩定的,因為環的幾何形狀的限制,不利於平面構型的存在,所以很少有橋頭碳正離子生成。但對橋頭碳負離子說,稜錐構型則是相對有利的,所以橋頭碳負離子是穩定的,可以存在的。正因如此,橋頭有機鋰化合物容易生成,例如下面通過橋頭碳負離子進行的反應是很順利的。這也為碳負離子的稜錐構型提供了進一步的證據。但當帶負電荷的中心碳原子與 鍵或芳環相連時,由於未共用的電子對能與 鍵發生共軛離域而穩定,這時碳負離子將取雜化的平面構型,以達到軌道最大的交蓋,更好地離域,使體系能量最低最穩定。
1.雜化效應 雜化軌道電負性大小順序是 > > 。電負性越大, 其拉電子能力越強, 所以碳負離子的穩定性有如下順序:叔碳正離子>仲碳正離子>伯碳正離子;如果碳正離子穩定性越強,它的酸性越強。
通過比較相應酸的酸性大小,可以大致判斷碳負離子的穩定性大小。
一般地,具有能穩定負電荷的基團的碳負離子具有較高的穩定性。這些基團可以是苯基、電負性較強的雜原子(如O,N,基團如、、 、 、和等)或末端炔烴(也可看作電負性的緣故),例如,三苯甲烷、三氰基甲烷、硝基甲烷和1,3-二羰基化合物具有較強的酸性。除此之外,不同於縮酮,縮硫酮的α氫也具有較強的酸性。這可以用硫的3d軌道與鍵軌道的超共軛效應來解釋。硫代硝基苯基甲烷的去質子化表明,硫的可極化性起主要作用。
3.共軛效應 當碳負離子與碳一碳雙鍵或苯環直接相連時, 由於共軛作用可使負電荷得到分散。因此碳負離子上連接的雙鍵(或苯環)越多, 碳負離子越穩定。共軛效應不僅使碳負離子的穩定性增加, 而且使碳負離子構型也發生變化: 一般碳負離子的構型為角錐型, 而有共扼效應的碳負離子可為平面構型。另外碳一氮、碳一氧、氮一氧重鍵對碳負離子也同樣有穩定作用。由於氮、氧比碳原子有較大的電負性, 能更好分散負電荷, 所以更能使碳負離子穩定, 其碳一質酸酸性更大。
4.溶劑效應 一般來說, 極性的質子溶劑能夠使正負離子溶劑化,而極性非質子溶劑如二甲基亞碸不能夠使負離子溶劑化,因此溶劑不同,碳負離子的活性和穩定性是不同的。、
有機金屬化合物,如Grignard試劑和有機鋰試劑也可看作是碳負離子源。葉立德,如磷葉立德和硫葉立德等,都含有具有碳負離子結構的共振雜化體。
碳負離子可進行反應。
碳負離子在有機合成中有著極其重要的地位。它參與了許多重要的有機合成反應,比如:酯縮合,羥醛縮合,witting反應,麥克爾加成等。認識碳負離子有助於我們認識正確的有機合成本質。